14.1. Свойства никеля и его соединений |
Содержание > ГЛАВА 14. Электрометаллургия ферроникеля > 14.1. Свойства никеля и его соединений
Атомный номер никеля 28, атомная масса 58,6934, конфигурация внешней электронной оболочки атома 3d84s2, относится к переходным элементам триады железа, температура плавления 1451оС, температура кипения 2960оС, плотность 8,92 г/см3, энтропия S![]() 29,87 Дж/(моль×K).
29,87 Дж/(моль×K).
Система Ni–Fe (рис. 14.1). Сплав системы Ni–Fe в твердом виде представляет собой непрерывные растворы на основе γ–Fe. В жидком состоянии оба элемента имеют также неограниченную растворимость.
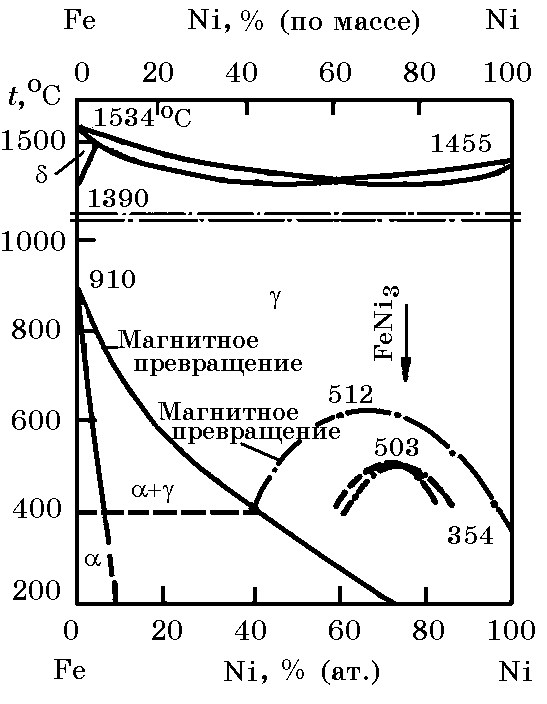
Рис. 14.1. Диаграмма равновесного состояния системы Ni–Fe
Система Ni–C (рис. 14.2). Диаграмма состояния системы Ni–C имеет простой эвтектический вид. Температура эвтектики – 1326оС. Максимальная растворимость углерода в твердом никеле при 1319оС равна 2,7% (ат.) С. В системе Ni-C существует метастабильный карбид Ni3C (прототип Fe3C). Растворимость углерода в жидком никеле в зависимости от температуры в интервале 1400–1700оС описывается выражением: lgxC = 1,55 – 896/T, где х – С, % (ат.); Т, K. Стандартная энтальпия карбида Ni3C ∆Н![]() = –38,49 Дж/моль. Изменение энергии Гиббса реакции образования Ni3C из элементов описывается уравнением, (Дж/моль): ∆G 0(280-1000) = –38511 + 9,92Т.
= –38,49 Дж/моль. Изменение энергии Гиббса реакции образования Ni3C из элементов описывается уравнением, (Дж/моль): ∆G 0(280-1000) = –38511 + 9,92Т.
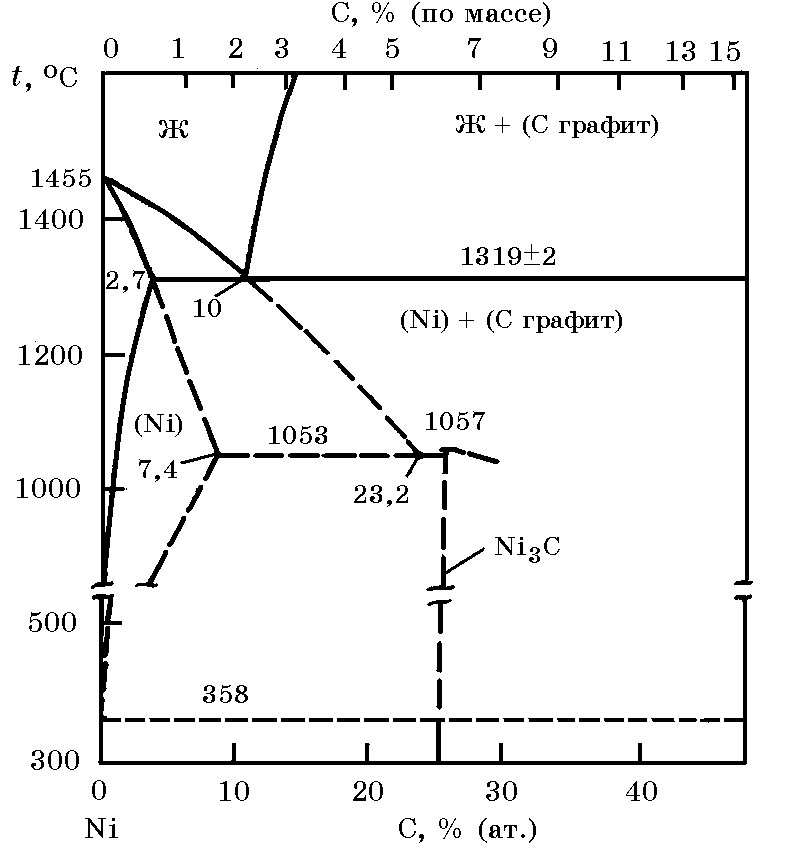
Рис. 14.2. Диаграмма равновесного состояния системы Ni–C
Система Ni–Si (рис. 14.3). Никель с кремнием образует ряд термодинамически прочных силицидов Ni3Si (13,76% Si), Ni3Si2 (16,07% Si), Ni2Si (19,31% Si), Ni5Si3 (24,19% Si), NiSi (32,37% Si) и NiSi2 (48,90% Si). Кремний в заметных количествах растворяется в жидком и твердом никеле, максимальная растворимость в твердом никеле достигает 9,4% Si при 1120оС. Повышение концентрации кремния в никеле снижает температуру плавления сплавов. Температура эвтектики 1125оС (11,5% Si). Методом калориметрии в изопериболическом режиме определены* парциальные и интегральные энтальпии расплавов системы Ni–Si при 1790оС ∆Hmin = –69 Дж/моль, при х = 0,45, ∆HSi = –208 кДж/моль; ∆HNi = –148 кДж/моль.
Система Ni–Al (рис. 14.4). В этой системе существует ряд никелидов алюминия NiAl3 (42,03 % Ni), Ni2Al3 (59,19% Ni), NiAl (68,51% Ni), Ni5Al3 (78,3% Ni) и Ni3Al (86,71% Ni). Растворимость алюминия в твердом никеле большая, хотя никель в твердом алюминии имеет крайне низкую растворимость.
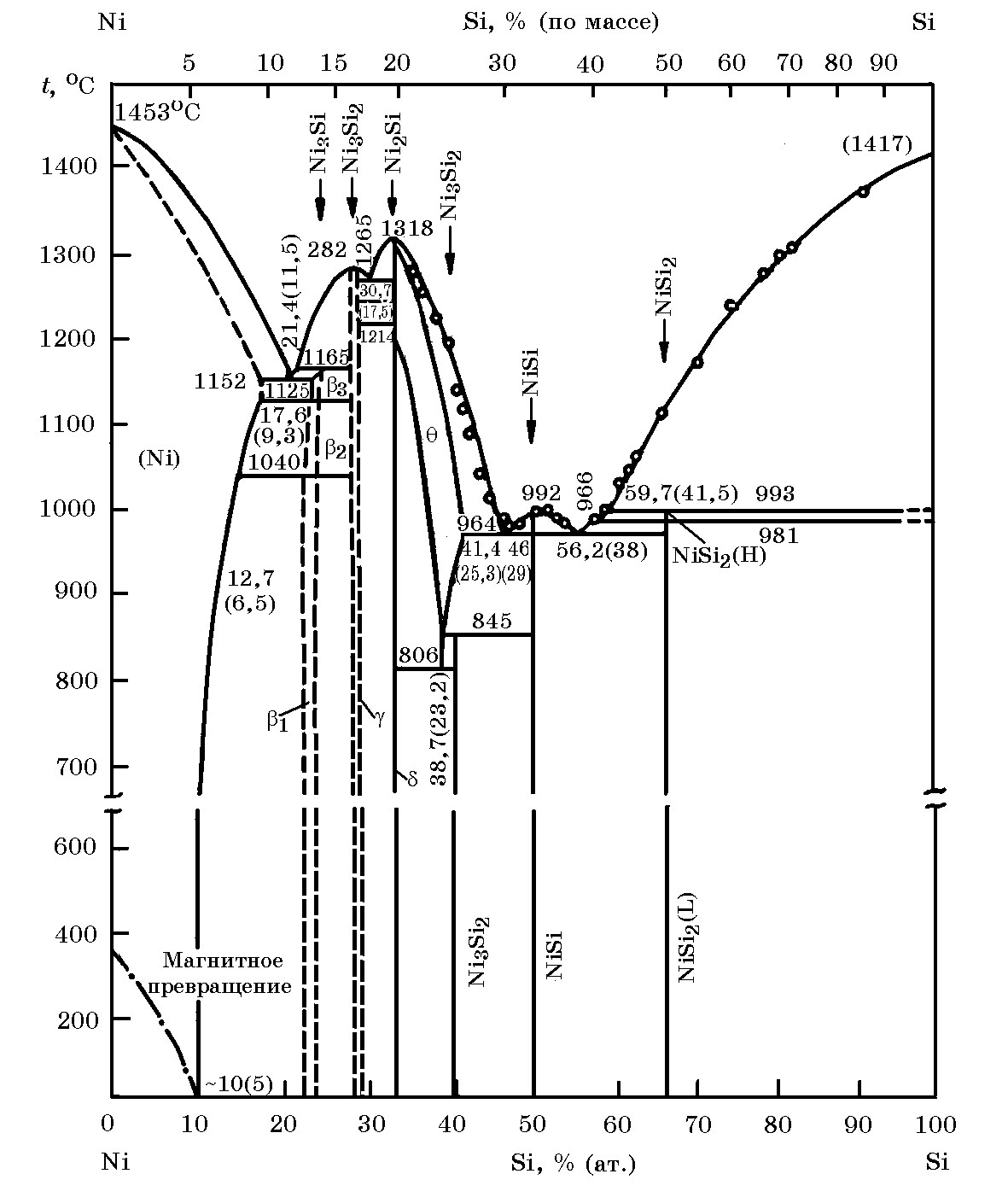
Рис. 14.3. Диаграмма равновесного состояния системы Ni–Si
Система Ni–S (рис. 14.5). В этой системе образуются сульфиды Ni3S2 (26,7% S), NiS (35,33% S), Ni3S4 (42,14% S) и Ni2S (52,22% S). В твердом никеле растворимость серы в равновесии с сульфидом Ni3S2 не превышает 0,005%.
Система Ni–Р (рис. 14.6.). Из множества фосфидов в системе Ni–P наиболее устойчив Ni5P2 (tпл = 1175оС) и Ni2P (tпл = 1110оС). Фосфид Ni3P изоморфен Fe3P и Mn3P. Повышение фосфора в никеле снижает температуру ликвидуса сплавов с 1452оС для чистого никеля до температуры эвтектики 880оС при 11% Р. Парциальная теплота растворения фосфора в никеле составляет ∆HT = –251 кДж/моль Р (в железе –140 кДж/моль Р).
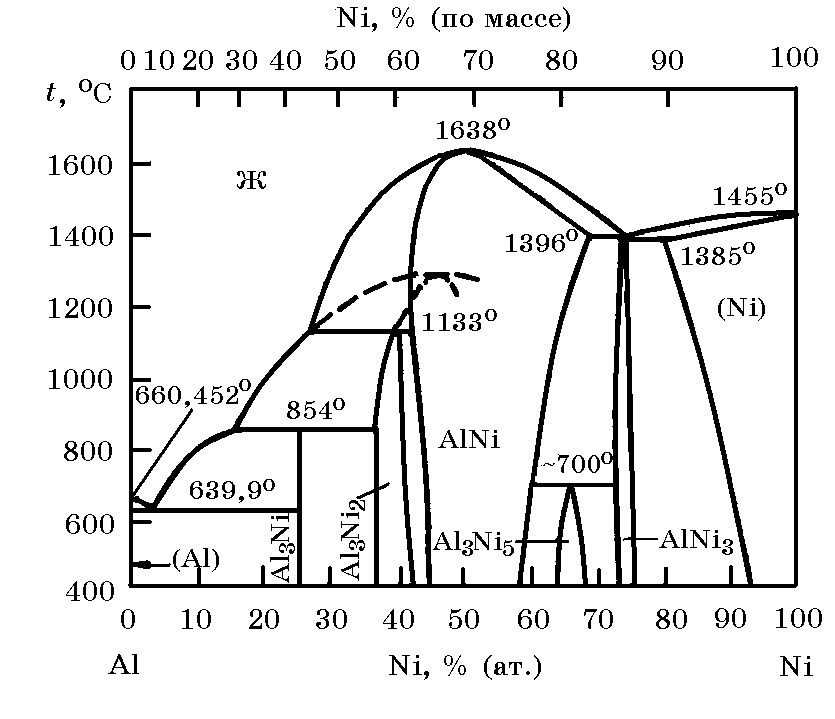
Рис. 14.4. Диаграмма равновесного состояния
системы Ni–Al
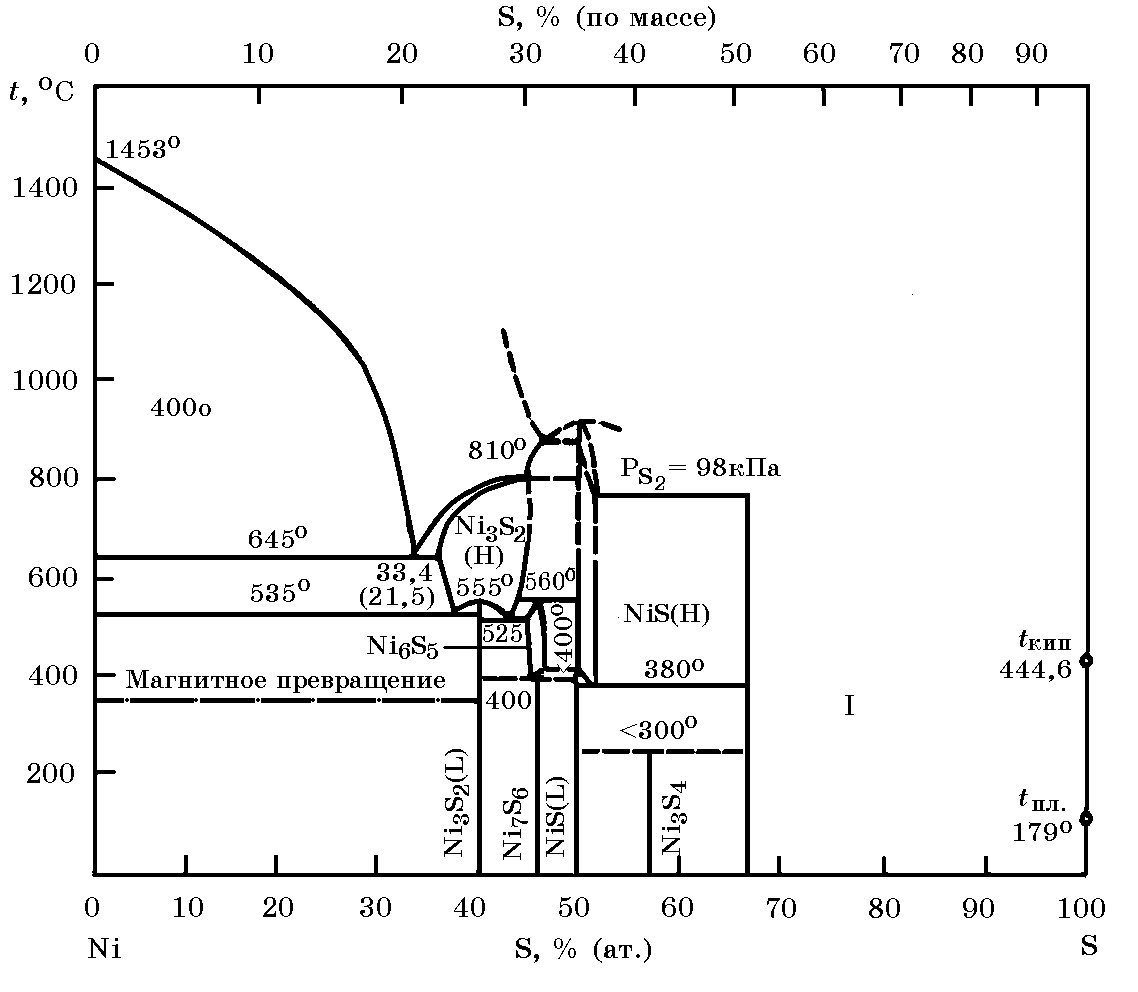
Рис. 14.5. Диаграмма равновесного состояния системы Ni–S, I – широкая область растворимости S в твердом NiS2

Рис. 14.6. Диаграмма равновесного состояния системы Ni–P
Система Ni–O (рис. 14.7). Кислород в никеле растворя-ется в значительных количествах, что следует из приведенных ниже данных:
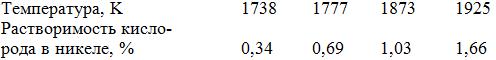
Первая парциальная энтальпия растворения кислорода в жидком никеле (Т = 1740–1779 K) равна ∆H = –200 кДж/моль. С кислородом никель образует оксиды NiO и Ni2O3.
Стандартная теплота образования NiO ∆Н![]() = –239,74 кДж/моль. Уравнение изменения энергии Гиббса реакции образования NiO из элементов 2Ni + O2 = 2NiO имеет вид (Дж/моль): ∆G
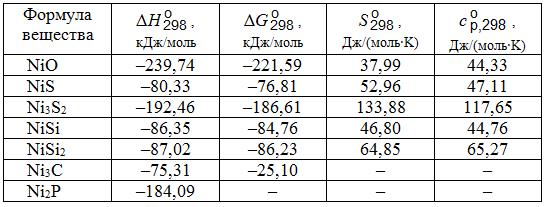
= –239,74 кДж/моль. Уравнение изменения энергии Гиббса реакции образования NiO из элементов 2Ni + O2 = 2NiO имеет вид (Дж/моль): ∆G![]() = –456056 + 161,9Т. Сводные данные о термодинамических константах соединений никеля приведены в табл. 14.1.
= –456056 + 161,9Т. Сводные данные о термодинамических константах соединений никеля приведены в табл. 14.1.
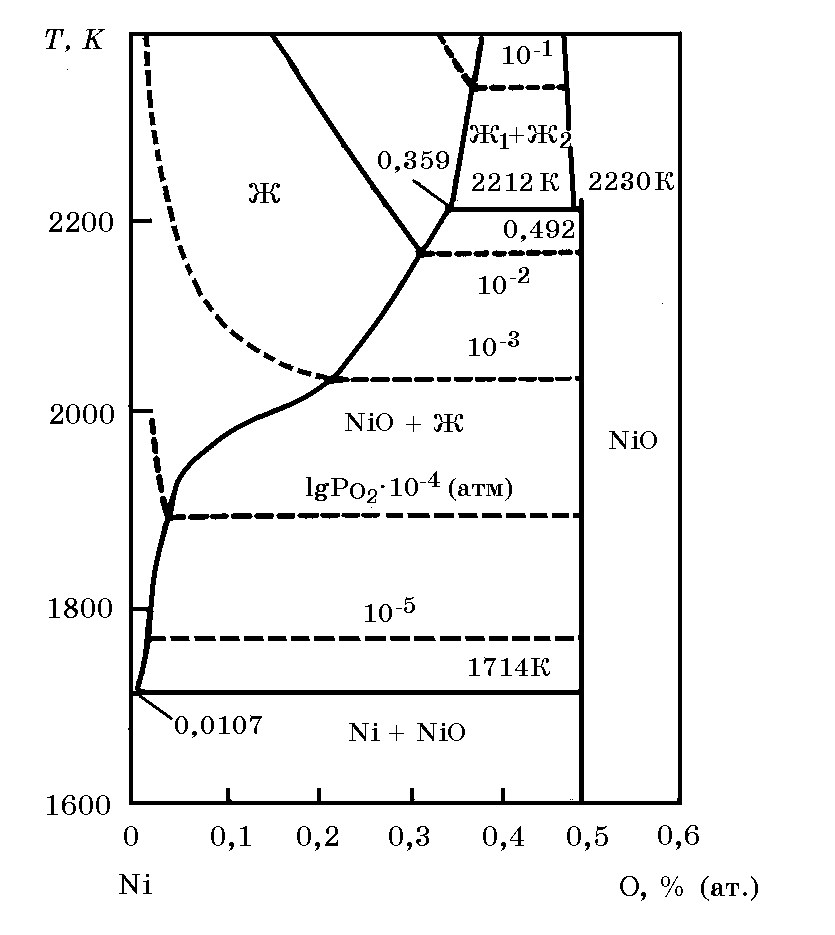
Рис. 14.7. Диаграмма равновесного состояния системы Ni–O
Таблица 14.1. Термодинамические константы соединений никеля
Никельсиликатные системы. В системе NiO–SiO2 известно соединение Ni2SiO4. Изменение энергии Гиббса реакции образования ортосиликата никеля из оксидов 2NiO + SiO2 = Ni2SiO4 описывается уравнением ∆G![]() = –23150 + 12,54Т Дж/моль. В тройной системе MgO-NiO-SiO2 образуются непрерывные твердые растворы. В пределах 50% Ni2SiO4 + 50% (мольн.) Mg2SiO4 – система истинно бинарная. В системе CaO–NiO–SiO2 имеется тройное соединение CaNiSi2O6. Ниоксид CaNiSi2O6 сосуществует с SiO2, CaSiO3, NiSiO4 и NiO.
= –23150 + 12,54Т Дж/моль. В тройной системе MgO-NiO-SiO2 образуются непрерывные твердые растворы. В пределах 50% Ni2SiO4 + 50% (мольн.) Mg2SiO4 – система истинно бинарная. В системе CaO–NiO–SiO2 имеется тройное соединение CaNiSi2O6. Ниоксид CaNiSi2O6 сосуществует с SiO2, CaSiO3, NiSiO4 и NiO.