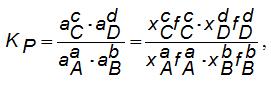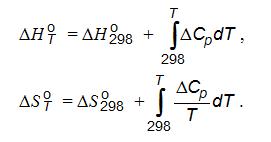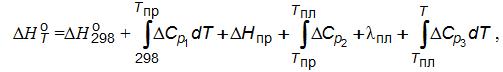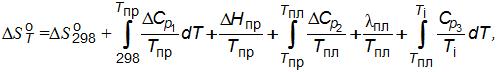1.1. Термохимия ферросплавных процессов |
Содержание > Глава 1. Физико-химические основы ферросплавных процессов > 1.1. Термохимия ферросплавных процессов
Ферросплавные процессы основываются на законах физической химии, а конкретнее — на законах химической термодинамики (термохимии)и химической кинетики (термокинетики). Законы химической термодинамики при помощи математического аппарата позволяют решать задачи и получать ответы на вопросы: может ли та или иная реакция протекать при конкретных заданных параметрах процесса (температуре Т и давлении Р) и, если может, то в каком направлении она будет идти. Таким образом, законы химической термодинамики решают задачу о возможности и направленности химической реакции при заданных параметрах процесса. Законы химической кинетики дают возможность оценить по известным аналитическим связям время, в течении которого данная реакция при изменившихся параметрах процесса (Т, Р) может из неравновесной перейти в равновесное состояние.
Термохимия это раздел химической термодинамики в приложении к высокотемпературным химическим (металлургическим) процессам. Возможность и направленность реакций в термохимических процессах определяется термодинамической величиной – изменением энергии Гиббса (∆G  ):
):
для стандартного состояния (Т = 298 K, Р = 101,3 кПа) функция ∆G  имеет вид прямой у = b – kx;
имеет вид прямой у = b – kx;
∆G  = ∆Н
= ∆Н  – Т∆S
– Т∆S  , где ∆Н
, где ∆Н  – изменение энтальпии, а ∆S
– изменение энтальпии, а ∆S  - изменение энтропии реакции.
- изменение энтропии реакции.
Входящие в эту формулу величины имеют следующую размерность: ∆G  – Дж/моль; ∆Н
– Дж/моль; ∆Н  – Дж/моль;∆S
– Дж/моль;∆S  – Дж/(моль К); Т – K.
– Дж/(моль К); Т – K.
Ферросплавный процесс с участием многокомпонентных шихтовых материалов может быть сведен к однойопределяющей цель и задачу технологического процесса реакции, которая запишется в следующем виде:
аА + bВ ↔ сС + dD±∆Н.
Константа равновесия (KР*)реакции, являющаяся математическим выражением закона действующих масс, имеет вид:
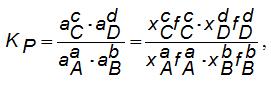
где а – активности участвующих в реакции компонентов; х – мольные доли соответствующего компонента; f– коэффициенты активности этих компонентов.
При температурах ферросплавных процессов возможность и направленность реакций оценивают по величине ∆G = ∆Н
= ∆Н - ∆S×T.
- ∆S×T.
Аналитическое исследование функции ∆G (Т)свидетельствует, что величина ∆G
(Т)свидетельствует, что величина ∆G может принимать три значения: 1) ∆G
может принимать три значения: 1) ∆G < 0; 2) ∆G
< 0; 2) ∆G > 0; 3) ∆G
> 0; 3) ∆G = 0. В физической химии принято, что если ∆G
= 0. В физической химии принято, что если ∆G <0, реакция для заданных условий (Т, Р) протекает в прямом направлении (т.е. в сторону образования продуктов реакции); если ∆G
<0, реакция для заданных условий (Т, Р) протекает в прямом направлении (т.е. в сторону образования продуктов реакции); если ∆G > 0, — реакция, если она находилась в равновесии, при изменении Т, Р должна смещаться в сторону исходных компонентов и, если ∆G
> 0, — реакция, если она находилась в равновесии, при изменении Т, Р должна смещаться в сторону исходных компонентов и, если ∆G = 0, — реакция находится в равновесии. В учебной, а иногда и в научной литературе, весьма часто условия ∆G
= 0, — реакция находится в равновесии. В учебной, а иногда и в научной литературе, весьма часто условия ∆G > 0 интерпретируется не совсем корректно. Указывается, что при этом условии исходные компоненты реакции не будут взаимодействовать. Следует иметь в виду, что при ∆G
> 0 интерпретируется не совсем корректно. Указывается, что при этом условии исходные компоненты реакции не будут взаимодействовать. Следует иметь в виду, что при ∆G > 0 и определенных параметрах (Т, Р) реакция может протекать, однако выход продуктов реакции будет не полный; если же реакция находилась в равнове- сии, а условия изменились так, что величина ∆G
> 0 и определенных параметрах (Т, Р) реакция может протекать, однако выход продуктов реакции будет не полный; если же реакция находилась в равнове- сии, а условия изменились так, что величина ∆G стала больше нуля, то реакция сместится в сторону исходных компонентов и выход продуктов реакции уменьшится.
стала больше нуля, то реакция сместится в сторону исходных компонентов и выход продуктов реакции уменьшится.
В теории электрометаллургических (ферросплавных) процессов, температуру, соответствующую условию ∆G = 0, принимают за температуру начала химической реакции, хотя, как указано выше, реакция и при условии ∆G
= 0, принимают за температуру начала химической реакции, хотя, как указано выше, реакция и при условии ∆G > 0 может протекать, но с меньшим выходом продуктов, чем при условии ∆G
> 0 может протекать, но с меньшим выходом продуктов, чем при условии ∆G < 0.
< 0.
Поскольку ∆G и константа равновесия реакции KР взаимосвязаны соотношением:
и константа равновесия реакции KР взаимосвязаны соотношением:
∆G = – RT ln KР,
= – RT ln KР,
условия ∆G < 0 соответствуют KР > 1; ∆G
< 0 соответствуют KР > 1; ∆G > 0, KР< 1 и ∆G
> 0, KР< 1 и ∆G = 0 при KР = 1.
= 0 при KР = 1.
Для большинства индивидуальных веществ и химических реакций, протекающих в ферросплавных процессах, термодинамические функции приведены для стандартных условий. В реальных условиях эти процессы протекают при высоких и весьма высоких температурах. При полном описании термодинамики реакций рассчитывают величину ∆G (Т) для любой заданной высокой температуры. Для этого предварительно рассчитывают ∆Н
(Т) для любой заданной высокой температуры. Для этого предварительно рассчитывают ∆Н (Т)и ∆S
(Т)и ∆S (Т):
(Т):
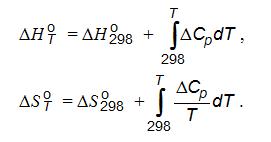
Многие компоненты, участвующие в реакциях ферросплавных процессов, испытывают фазовые превращения, сопровождающиеся изменением их кристаллохимических структур и агрегатного состояния. Эти превращения сопряжены с изменением энергии в реагирующих системах, которая должно учитываться в более точных термодинамических расчетах ∆Н (Т)и ∆S
(Т)и ∆S (Т)по приведенным ниже формулам:
(Т)по приведенным ниже формулам:
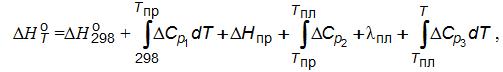
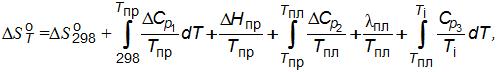
где ∆СР – изменение теплоемкости веществ, Дж/(моль K; ∆Нпри lпл – энтальпия превращения компонентов и теплота плавления веществ, соответственно.
Возможность и направленность реакции можно оценивать по величине константы равновесия. Условие KР= 1 соответствует равновесию реакции, KР > 1 – реакция протекает в сторону образования продуктов реакции и KР< 1 – выход продуктов реакции снижается.
Поскольку ∆G = –RTlnKР = ∆Н
= –RTlnKР = ∆Н – ∆S
– ∆S Т, то lnKР, = –∆Н
Т, то lnKР, = –∆Н /RT +∆S
/RT +∆S /RT; обозначив –∆Н
/RT; обозначив –∆Н /R= –А и ∆S
/R= –А и ∆S /R= В, получают зависимость KР(T)(формулу Аррениуса):
/R= В, получают зависимость KР(T)(формулу Аррениуса):
lnKР= –А/Т + В.
Таким образом, константа равновесия реакции зависит от температуры (при постоянном давлении) и не зависит от активности (концентрации) участвующих в реакции компонентов. При наличии в системе конденсированных и газообразных компонентов константы равновесия есть функции температуры и давления.
В ферросплавных процессах реакции могут быть эндотермическими (углеродотермические процессы с участием твердого углерода) и экзотермическими (металлотермические процессы). В некоторых случаях важно оценить влияние температуры (давления) на направленность реакции. Оценку внешнего воздействия можно производить используя теорему (принцип) Ле-Шателье: “Если нарушить условия системы, находившейся в равновесии, то в системе стремится протекать такая реакция, которая противодействует произошедшему нарушению, т.е. реакция, частично уничтожает эффект нарушения”.
В соответствии с уравнением Вант-Гоффа константа равновесия связана с изменением энтальпии реакции изобарой
∆Н = RT2(dlnKР)/dT).
= RT2(dlnKР)/dT).
Количественное выражение теоремы Ле-Шателье дается уравнением Клаузиуса-Клапейрона
dР/dT = Q/T∆V,
где dР/dТ – изменение давления при изменении температуры Т; Q – теплота поглощения или выделяемая граммом вещества; ∆V – изменение удельного объема, сопровождающее реакции.
______________
* Константа равновесия реакции может быть безразмерной величиной (когда все входящие величины выражены через активности) или иметь размерность, если наряду сактивностями входят величины парциальных давлений некоторых компонентов, например K= аSi∙р2CO.