4.1 Свойства кремния и его соединений |
Содержание > ГЛАВА 4. Электрометаллургия кремния и карбида кремния > 4.1 Свойства кремния и его соединений
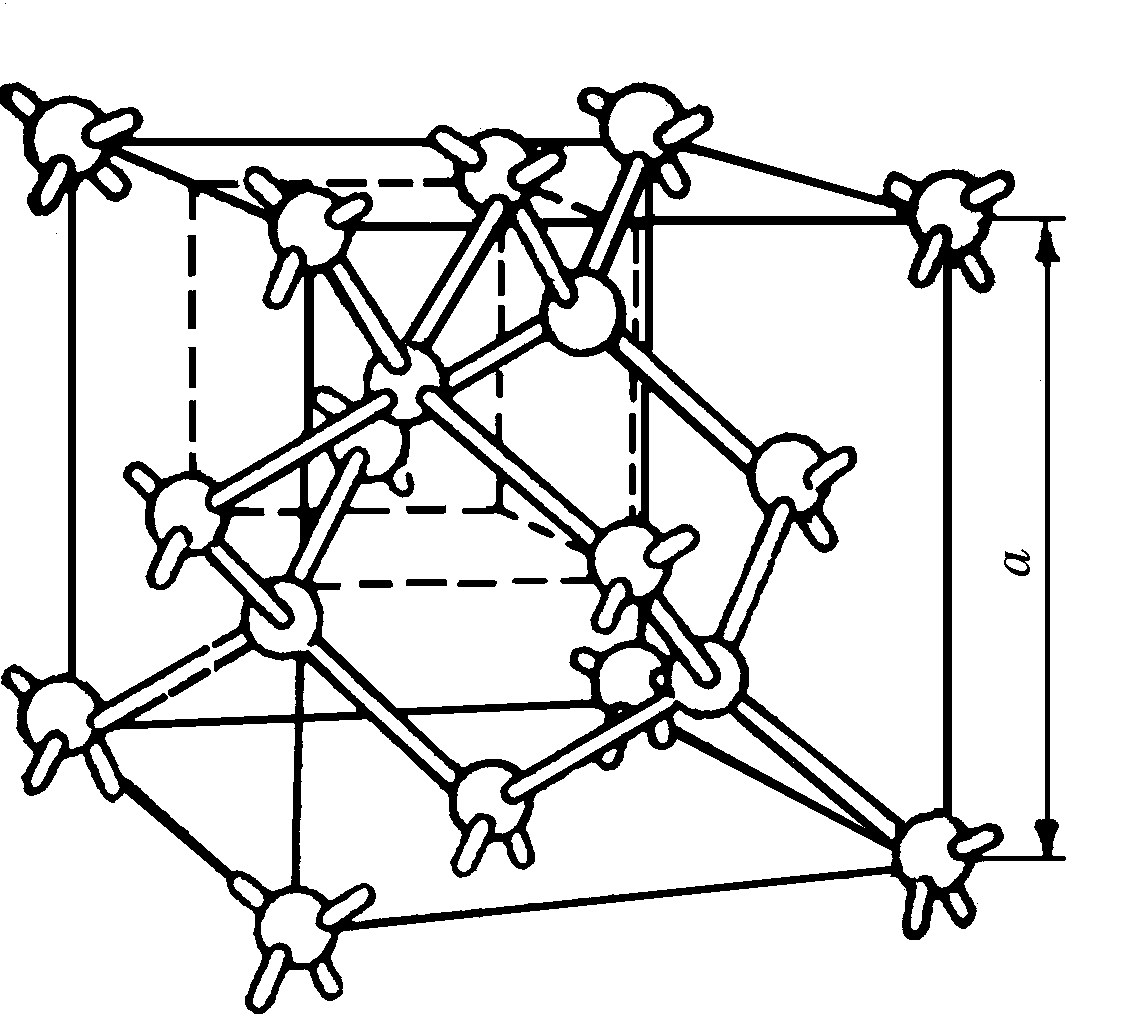
Кремний относится к VIa группе Периодической системы элементов Д.И.Менделеева, порядковый номер кремния 14, атомная масса 28,08, конфигурация электронной оболочки 3s23p2, проявляет степень окисления 4 (наиболее устойчивая), 3, 2 и 1. Температура плавления кремния 1415оС, температура кипения 3250оС. Кристаллическая решетка кремния кубическая, гранецентрированная типа алмаза (рис. 4.1). Сродство атома кремния к электрону 1,22 эВ, электроотрицательность по Полингу 1,8, атомный радиус 0,133 нм, ионный радиус Si4+ 0,040 нм (координационное число 4), ковалентный радиус 0,1175 нм.

Рис. 4.1. Элементарная гранецентрированная кубическая решетка кремния, параметр
а = 0,54307 нм
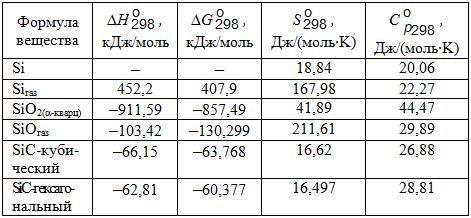
В табл. 4.1 приводятся термодинамические константы кремния и некоторых его соединений.
Таблица 4.1. Термодинамические константы кремния и некоторых его соединений
Кремний плавится с уменьшением объема на 9%. Плотность кремния составляет 2,33 г/см3. В интервале 1687—1973К зависимость плотности от температуры описывается выражением (г/см3):
dSi = 2,49 – 2,722∙10-4 (Т – 1687).
Cистема Si-O (рис. 4.2). Растворимость кислорода в твердом кремнии очень мала, поэтому на диаграмме состояния эта область не показана. Температурная зависимость растворимого кислорода в жидком кремнии имеет вид:
lg[%O]Si = –6975/T + 1,5205.
Изменение энергии Гиббса реакции растворения молекулярного кислорода в жидком кремнии описывается уравнением: ∆G![]() = –339663 + 69,9Т, (Дж/моль 1/2О2).
= –339663 + 69,9Т, (Дж/моль 1/2О2).

Рис. 4.2. Диаграмма равновесного состояния системы Si–O
Изменение энергии Гиббса реакций образования кремнезема с учетом агрегатного состояния кремния характеризуется следующими уравнениями:
Sіт + O2 = SiO2(т),
∆G![]() = –883500 – 12,56ТlgТ + 218,7Т, Дж/моль;
= –883500 – 12,56ТlgТ + 218,7Т, Дж/моль;
Siж + O2 = SiO2(т),
∆G![]() = –932500 – 12,77ТlgТ + 250,3Т, Дж/моль.
= –932500 – 12,77ТlgТ + 250,3Т, Дж/моль.
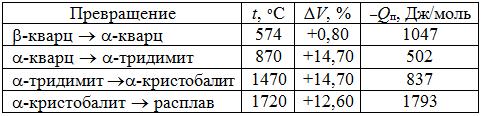
Наиболее стабильной фазой является SiO2 (кварц), tпл = 1726 оС и tкип = 2275оС, кремнезем имеет несколько модификаций, устойчивых в определенных температурных интервалах (табл. 4.2).
Таблица 4.2. Характеристика основных фазовых превращений кремнезема при рO2 = 105 Па (Qп – теплота фазового превращения)
Превращение кварца при нагреве (охлаждении) сопровождается сравнительно большим изменением объема, приводящим иногда к растрескиванию кварца (кварцита), как компонента шихты, на колошнике ванны печи. Последовательность фазовых переходов кварца представлена на приведенной ниже схеме:

Не все модификации кремнезема имеют одинаковое значение для характеристики поведения кварцита при выплавке ферросилиция и других кремнистых ферросплавов.
По скорости модификационных превращений кварца выделяют две группы переходов. К первой группе отнесены протекающие быстро переходы в какой-либо главной форме SiO2, причем в двух направлениях, т.е. энантиотропно. На схеме они указаны вертикальными стрелками с указанием температур. Высокая скорость этих переходов объясняется малыми изменениями параметров решеток. Так, при переходе β-кварц ↔ α-кварц объем увеличивается всего на +0,8%, тогда как переход α-кварц ↔ α-тридимит сопровождается изменением объема на +14,7%.
Вторая группа переходов, протекающих медленно, расположена в горизонтальном ряду вследствие глубокой перестройки кристаллических решеток. Например α-кварц может быть расплавлен, находясь в неустойчивом состоянии. При обычных условиях устойчивой формой является β-кварц (см. схему), поэтому в природе существует кварц и много разновидностей кварцевых минералов именно в β-форме (горный хрусталь, жильный кварц, кварцевые пески, песчаники, кварциты, халцедон, кремень и др.).
Основной кристаллохимической структурной единицей кварца является кремнекислородный тетраэдр [SiО4]4- (рис. 4.3), атом кремния в котором находится в центре тетраэдра и по его вершинам*. Расстояние между атомами кремния и кислорода Si–О равно расстоянии 0,162 нм, а ближайшиеатомы кислорода находятся друг от друга на 0,264 нм, угол ОSiO равен 109028/. Заряд тетраэдра равен –4. Тетраэдры [SiО4]4- могут соприкасаться, образуя различные более сложные структурные конфигурации.
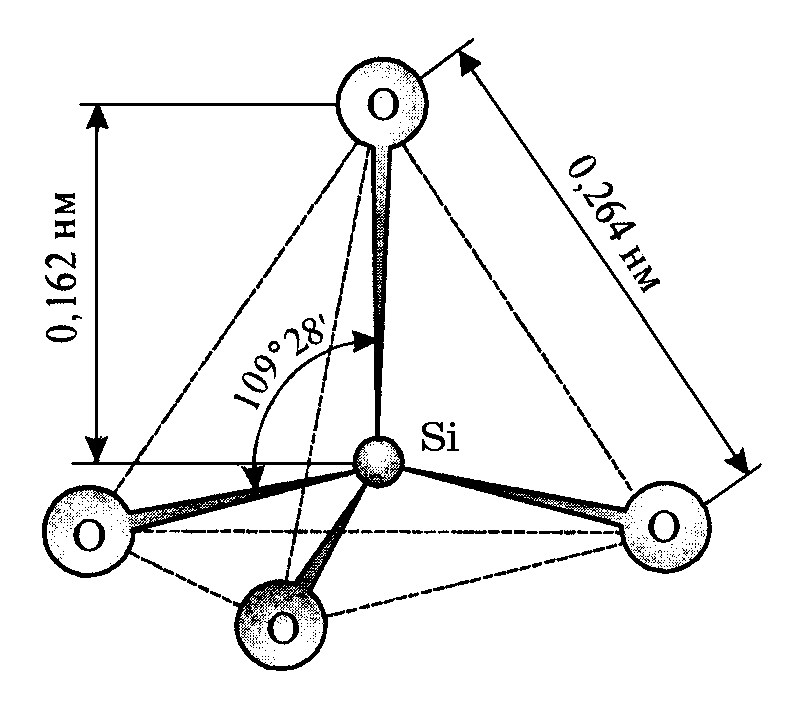
Рис. 4.3. Схема элементарного тетраэдра SiO![]()
Современные представления о расплавах силикатов. Бинарные и более сложные силикаты, по О.А. Есину, являются полианионными жидкостями, представленными набором анионов SiiO
Свойства углерода. Атомный номер углерода 6, атомная масса 12,011. При нормальном давлении углерод не плавится.
Для перехода углерода в жидкое состояние необходимы высокие температуры и давления. Как следует из рис. 4.4. условия равновесия перехода углерода твердое ↔ жидкое состояние определяются линией, разграничивающей области 1и 2. Например, для получения углерода в жидком виде при 3000 K необходимо давление >400 ГПа.
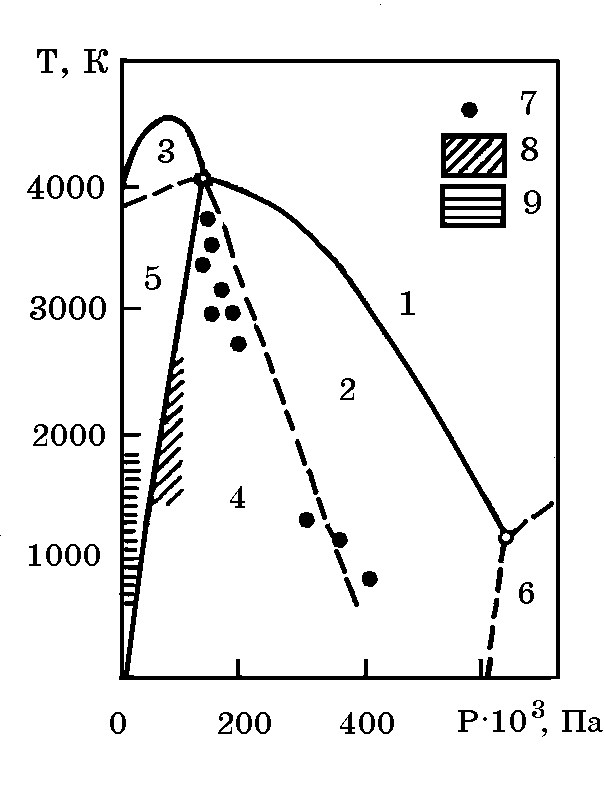
Рис. 4.4. Диаграмма состояния
углерода:
1 – жидкость; 2 – стабильный алмаз; 3 – стабильный графит; 4 – стабильный алмаз и метастабильный графит; 5 – стабильный графит и метастабильный алмаз; 6 – гипотетическая область иных твердых модификаций углерода; 7 – точки, соответствующие условиям прямого превращения графита в алмаз; 8 – области образования алмазов с использованием металлов; 9 – область опытов по образованию алмаза при низком давлении
Система С–О. Взаимодействие углерода и киcлорода при определенных условиях может приводить к образованию СО и СО2. Для реакции 2С + О2 = 2СО константа равновесия имеет вид:
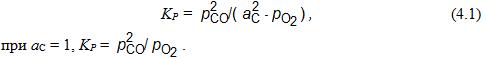
Температурная зависимость lgKPопределяется по уравнению lgKP= 56324/Т + 36,89 и ∆G![]() = –236000 – 168,8Т, Дж/моль О2.
= –236000 – 168,8Т, Дж/моль О2.
Для реакции С + О2 = СО2 константа равновесия:
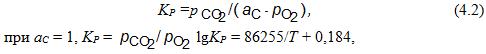
∆G![]() = –394210 – 0,842Т, Дж/моль О2.
= –394210 – 0,842Т, Дж/моль О2.
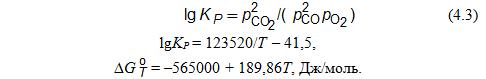
Углерод и диоксид углерода могут взаимодействовать по реакции СО2 + С = 2СО, константа равновесия которой
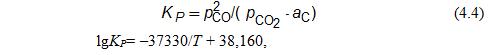
∆G![]() = 170780 – 174,58, Дж/моль.
= 170780 – 174,58, Дж/моль.
На рис. 4.5. показана зависимость ∆G![]() (Т) для реакции (4.1) – (4.4).
(Т) для реакции (4.1) – (4.4).
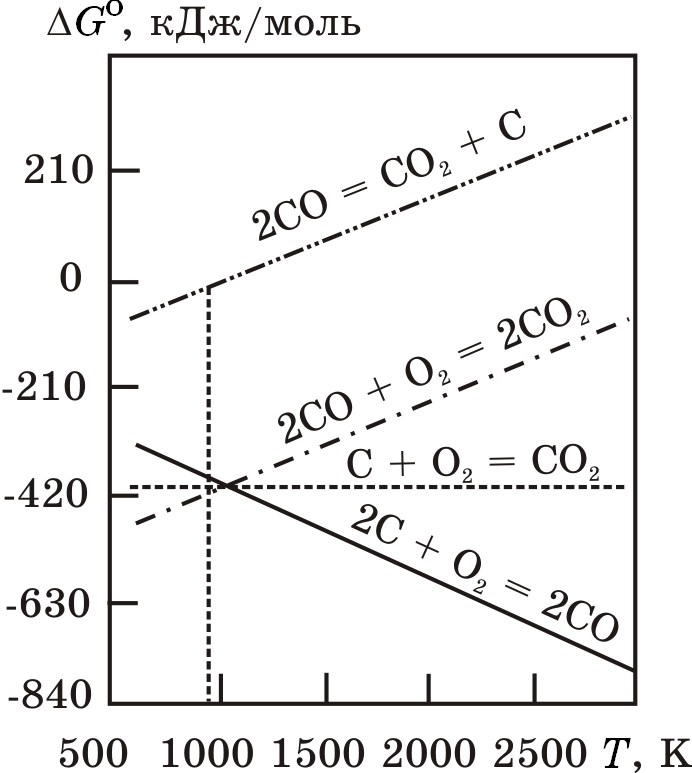
Рис. 4.5. Зависимость изменения энергии Гиббса от температуры реакций взаимодействия в системе С–О
Анализ уравнений показывает, что термодинамическая вероятность протекания реакции (4.3) уменьшается, а реакции (4.1) увеличивается с повышением температуры. Изменение температуры вследствие незначительного изменения энтропии реакции слабо влияет на термодинамическую вероятность протекания реакции (4.2). Прямые ∆G![]() = f(Т)на рис. 4.5 для реакций (4.1), (4.2) и (4.3) пересекаются в точке, соответствующей температуре 976 K. В условиях избытка углерода и при Т >1300 K единственным продуктом взаимодействия углерода с кислородом является СО. При избытке кислорода углерод иСО окисляются до СО2.
= f(Т)на рис. 4.5 для реакций (4.1), (4.2) и (4.3) пересекаются в точке, соответствующей температуре 976 K. В условиях избытка углерода и при Т >1300 K единственным продуктом взаимодействия углерода с кислородом является СО. При избытке кислорода углерод иСО окисляются до СО2.
Система Si–С. Диаграмма состояния системы Si–С представлена на риc. 4.6. Растворимость углерода в твердом кремнии очень низкая, а в жидком состоянии существенно увеличивается. Зависимость [%C] = f(1/T) имеет вид*
[%C] = 3359×exp(22147/Т).
В этой системе образуется карбид SiС состава 70%Si и 30% С, который при 2545оС превращается по перитектической реакции.
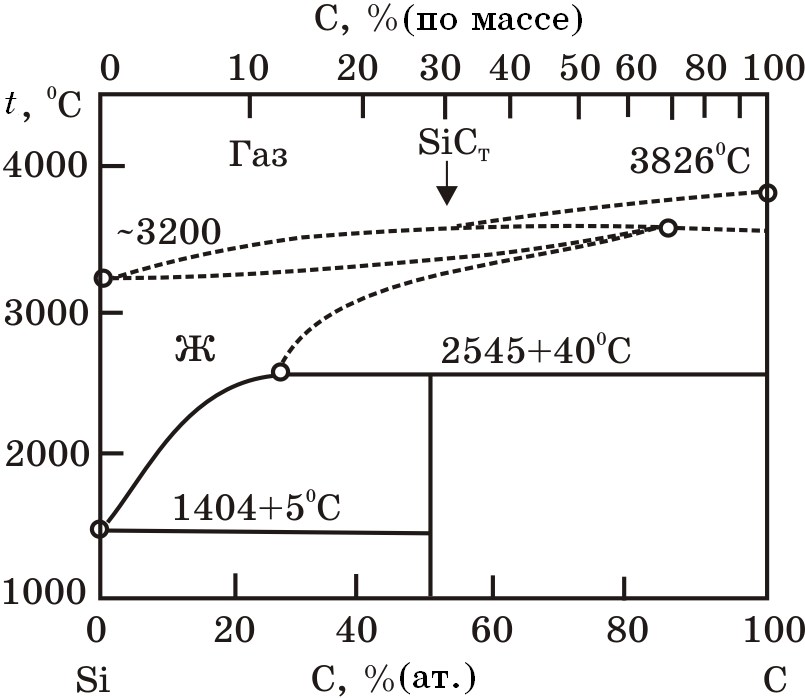
Рис. 4.6. Диаграмма равновесного состояния системы Si–C
Реакция взаимодействия твердого кремния с углеродом Siт + Ст = SiСт характеризуется изменением энергии Гиббса ∆G![]() = –53510 + 69,5Т, а для реакции с участием жидкого кремния
= –53510 + 69,5Т, а для реакции с участием жидкого кремния
Siж+Ст = SiСт
уравнение изменения энергии Гиббса имеет вид: ∆G![]() = –100600 + 34,9Т. Газовая фаза над карбидом SiC имеет сложный состав, зависящий от температуры. Так, при 2000 K газовая фаза содержит, % (объемн.): 86,5Si; 6,1 SiС2; 7,4 SiС.
= –100600 + 34,9Т. Газовая фаза над карбидом SiC имеет сложный состав, зависящий от температуры. Так, при 2000 K газовая фаза содержит, % (объемн.): 86,5Si; 6,1 SiС2; 7,4 SiС.
Плотность карбида кремния равна 3,22 г/см3.
Удельное электрическое сопротивление карбида кремния при температурах до 1273 K составляет 1,3 Ом∙м. Карбид кремния бесцветен, наличие примесей окрашивают его в зеленый или черный цвет.
_____________________
*Klevan O.S., Engh T.A. INFACON – 7.(1995). P.441-450.