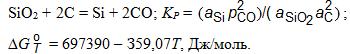
4.2 Теоретические основы восстановления кремния углеродом |
Содержание > ГЛАВА 4. Электрометаллургия кремния и карбида кремния > 4.2 Теоретические основы восстановления кремния углеродом
Балансовая реакция, характеризующая процесс восстановления кремния из кремнезема углеродом, при получении кристаллического кремния может быть представлена в следующем виде:
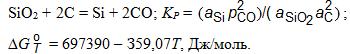
Теоретическая температура начало реакции (∆G![]() = 0) 1942 K (1669оС).
= 0) 1942 K (1669оС).
Однако реально процесс восстановления кремния углеродом при различных температурах протекает через стадии образования промежуточных продуктов SiОгаз и SiСт, которые необходимо учитывать при термодинамическом анализе для правильного прогнозирования параметров технологии выплавки кристаллического кремния. Поэтому термодинамический анализ реакций восстановления Si из SiO2 углеродом может быть сведен к задаче выявления особенностей фазовых равновесий в системе Si–О–С.
Диаграмма фазовых равновесий в системе Si–О–С с учетом термодинамического анализа минимально необходимого комплекса простых реакций была рассчитана Н.В. Толстогузовым, И.С. Рябчиковым, С.М. Мазмишвили и др., что позволило уточнить термодинамику процессов в этой системе. Приняты следующие основные реакции, описывающие равновесие конденсированных фаз с газовой:
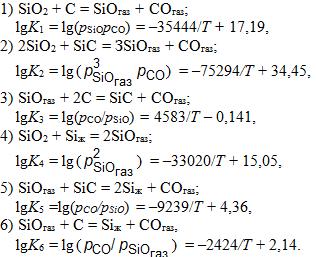
Используя эти уравнения для констант реакций, отношение рSiO/pCO для реакций 3, 5, 6 определяют из выражения:рSiO/pCO= 1/KP, для реакции 4 из уравнения:
![]()
для реакций 1 и 2 нужны решения системы уравнений:
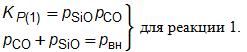
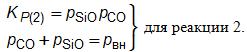
Результаты расчетов представлены в виде диаграммы в координатахрSiO/pCO = f(1/Т) для случая рвн = 101 кПа (рис. 4.7).
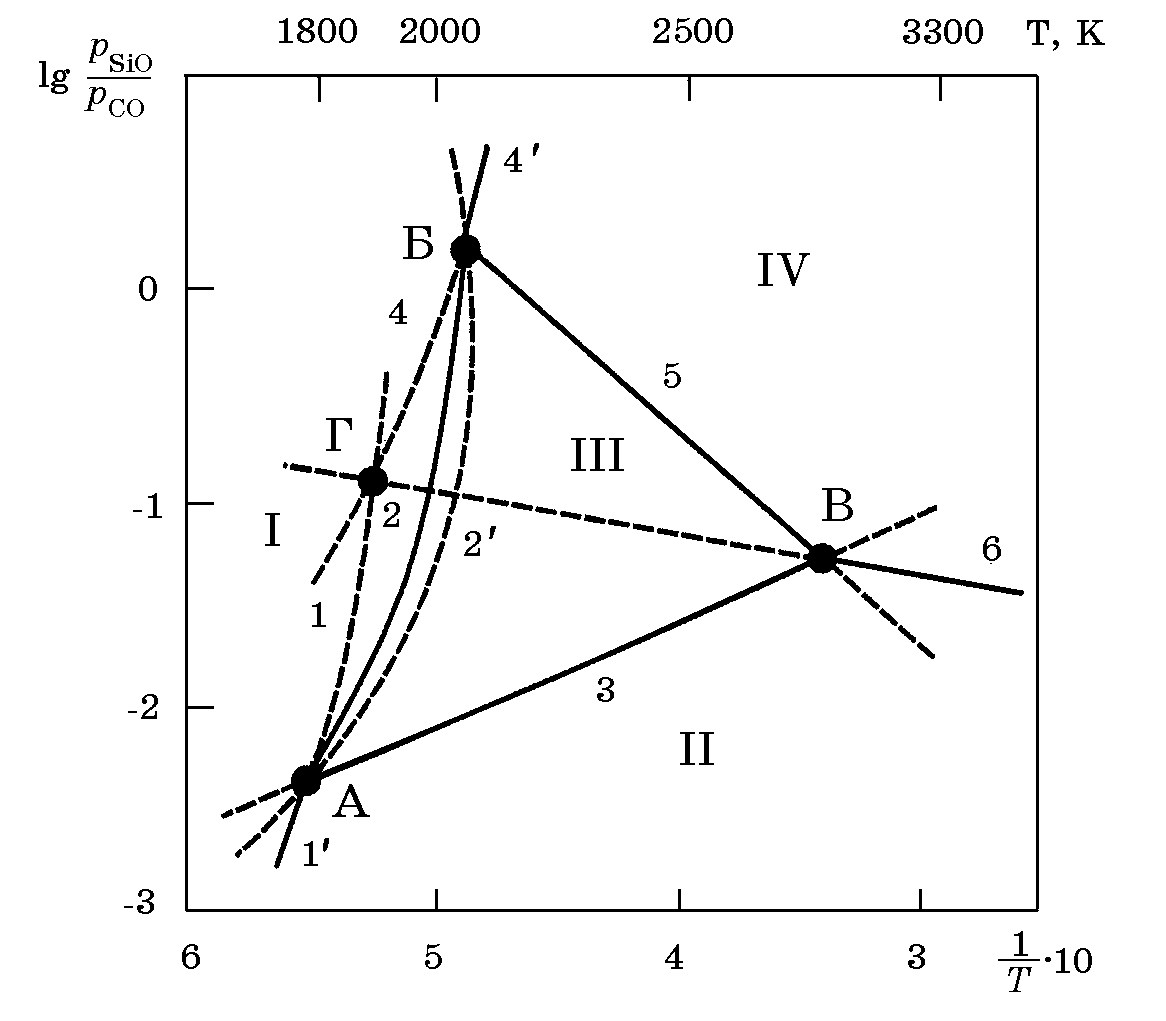
Рис. 4.7. Диаграмма зависимости lgрSiO/pCO) от температуры
в системе Si–O–С
На рис. 4.7 кривые 1–6 описывают равновесие соответствующих реакций и характеризуют условия сосуществования (при определенных значениях lg(рSiO/pCO) и температур) следующих конденсированных фаз: 1– SiO2 и С; 2– SiO2 и SiС; 3– SiС и С; 4 – SiО2 и Si; 5 – SiС и Si; 6– С и Si.
В отличие от реакций 1, 2 и 4 для реакций 3, 5, 6 зависимости lg(рSiO/pCO) от температуры характеризуются прямыми линиями 3, 5и 6. Пересечением линий поле диаграммы разграничивается на области устойчивости следующих конденсированных фаз: I – SiO2; II – С; III – SiС; IV – Si.
Характеристика нонвариантного равновесия в точках А, Б, В, Г с газовой фазой SiOгаз – CO:
А – нонвариантное стабильное равновесие трех конденсированных фаз SiO2, Si и С; координаты точки Т = 1796 K (1523оС);рSiO/pCO = 0,00575 при pвн = 101,3 кПа.
Б – нонвариантное стабильное равновесие конденсированных фаз SiO, SiC и Si; координаты точки Б: Т = 2090 K (1817оС);рSiO/pCO = 1,6.
В – нонвариантное стабильное равновесие конденсированных фаз Si, SiC, C; координаты точки В: Т = 3193 K (2920оС);рSiO/pCO = 0,0578.
Г – метабильное равновесие конденсированных фаз SiO2, C, Si; ее положение при pвн = 101,3 кПа характеризуется координатами Т = 1929 K (1656оС).