5.1 Сортамент, микроструктура и свойства ферросилиция |
Содержание > ГЛАВА 5. Электрометаллургия ферросилиция > 5.1 Сортамент, микроструктура и свойства ферросилиция
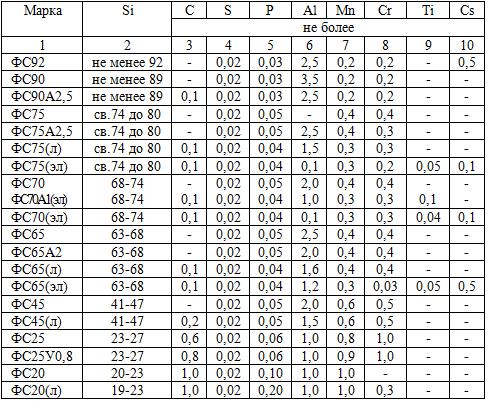
Сортамент ферросилиция. Ферросилиций представляет собой большую группу сплавов системы железо-кремний и предназначен для раскисления и легирования стали. Он широко применяется в литейной промышленности при производстве отливок из чугуна и стали, В соответствии со стандартом ГОСТ 1415-78 (с изменением №3 от 1988 г.) ферросилиций может производиться 20 марок с учетом функционального назначения каждой марки (табл. 5.1).
Так, например, сплав марки ФС75 (эл) предназначен для легирования электротехнической стали; ФС20(л), ФС45(л),ФС65(л) и ФС75(л) — для использования в производстве литых изделий.
В 1993г Госстандартом России и Межгосударственным Советом по стандартизации, метрологии и сертификации принят стандарт «Ферросилиций» (ГОСТ 1415-93) методом прямого применения стандарта ISО 5445-80. В России ГОСТ 1415-93 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1.01.1997 (табл. 5.2).
Таблица 5.1. Химический состав, %, ферросилиция (ГОСТ 1415-78, изменение №3 от 01.07.88г.)

П р и м е ч а н и е. В обозначении марок ферросилиция строчные буквы указывают на основное назначение: л — для литейного производства; эл – для выплавки электротехнической стали.
Таблица 5.2. Марки и химический состав ферросилиция по ГОСТ
1415-93
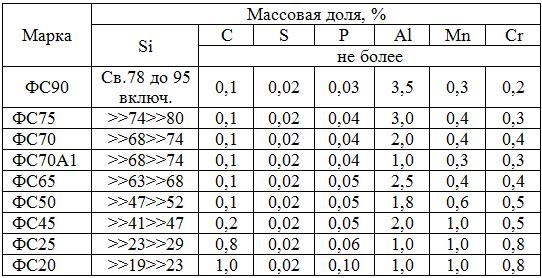
ГОСТ 1415-93 рекомендован также марочный и химический составы ферросилиция с принятым международным обозначением марок сплава от FeSi10 до FeSi90A12 (табл. 5.3).
В соответствии со стандартом Украины ДСТУ 4127-2002 (табл. 5.4) ферросилиций может производиться девяти марок от ФС10 (8…14% Si) до (включительно) ФС9О (87…95% Si).
Стандартом ДСТУ 4197-2002 допускается производство и поставка ферросилиция по международному стандарту ISO 5445: 1980 (табл. 5.3).
Система Fe–Si (рис. 5.1). Кремний относится к ферритообразующим элементам и поэтому сужает область γ–Fe (рис. 5.1). Максимальная растворимость кремния в γ-Fе составляет 1,63% Si. Двухфазная область (α+γ) простирается до 1,94% Si. В системе Fе–Si существует ряд силицидов:
Таблица 5.3. Марки и химический состав ферросилиция по стандарту ISO 5445: 1980
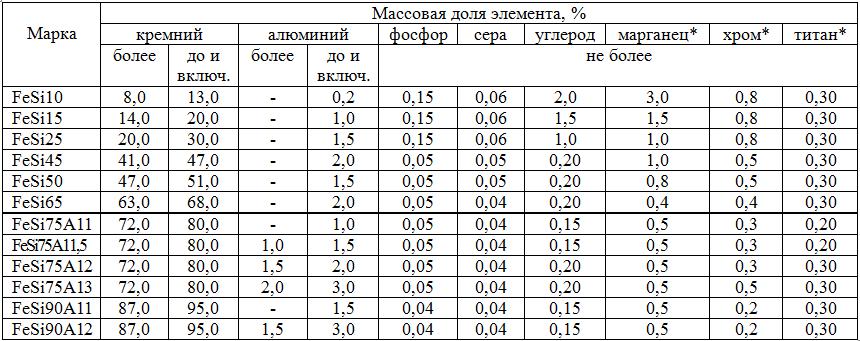
* Приведенные максимальные величины даются только для информации
Fe3Si (14,28% Si), Fe2Si (20,0 % Si), Fe5Si3 (23,18% Si), FeSi (33,46%) и FеSi2 (50,15% Si).
Таблица 5.4 Химический состав ферросилиция ДСТУ 4127–2002
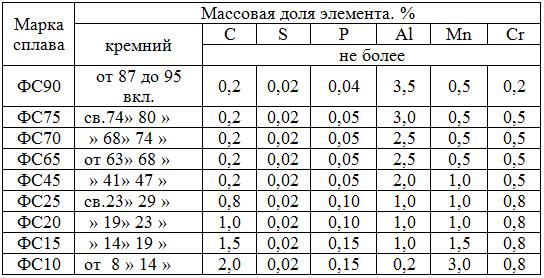
П р и м е ч а н и е. Буквы и цифры в обозначении марки ферросилиция означают: ФС – ферросилиций; цифры, следующие за буквами – массовую долю кремния
Бисилицид FeSi2 существует в двух модификациях: высокотемпературной FeSi2 (ВТ) в интервале 937-1220оС и низкотемпературной FeSi2 (НТ) ниже 937оС. Высокотемпературная модификация представляет собой нестехиометрическое соединение, существующее в определенном интервале концентрации кремния. В литературе этот силицид описывают формулой FeSi2,3, т.е. как фазу с избытком кремния. Прецизионными исследованиями, выполненными в 90-х годах, установлено, что дисилицид представляет соединение с дефицитом атомов железа, т.е. FexSi2, которое при 937оС эвтектоидно превращается в стехиометрический силицид FeSi2 и кремний по реакции
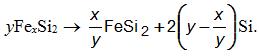
Термодинамические свойства сплавов системы Fe–Si. Н.А. Ватолин* и др. исследовали термодинамические свойства жидких и твердых сплавов системы Fe-Si сочетанием эффузионного метода Кнудсена и масс-спектрометрии в температурном интервале 1078-1509оС и диапазоне составов 9,2-82,2 ат. % Fe. Измерены величины давления паров железа и кремния над сплавами, химические составы которых соответствовали концентрационным областям двухфазных равновесий: Fe2Si (20 ат. %Si) + FeSi (33,3 ат.%Si), FeSi (33,3 ат. %Si) + FeSi2 (50 ат. %Si), а также температурно-концентрационным полям равновесий силицида с жидкостью.

Рис. 5.1. Диаграмма состояния системы Fе–Si
Установлено, что в расплавах системы Fe–Si в широком диапазоне химического состава протекают ассоциативные реакции с образованием жидких группировок Fe3Si; Fe2Si; FeSi и FeSi2. Для этих группировок рассчитаны значения ∆Н![]() и S
и S![]() :
:
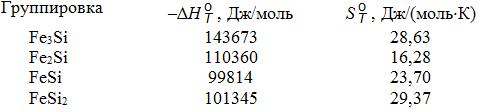
С ростом атомной доли кремния в составе расплавов системы Fe-Si увеличивается концентрация условно «свободного» кремния (рис. 5.2, кривая 2), а «свободного» железа уменьшается (кривая 1).
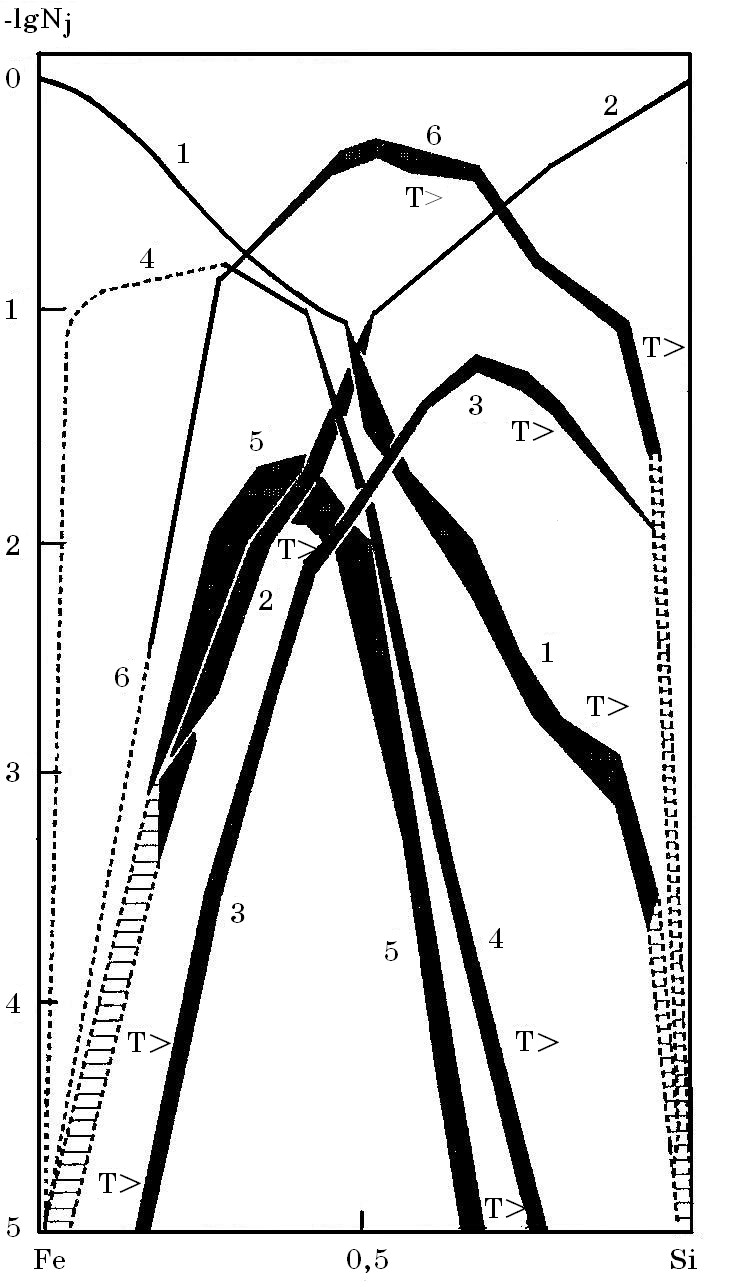
Рис.5.2. Состав расплава Fe-S: 1 – [Fe]; 2 – [Si}; 3 – [FeSi2]; 4 – [Fe3Si];
5 – [Fe5Si3]; 6 – [FeSi]
Знак «Т>» соответствует области изменения состава Т = 2003 K; другая граница (Т = 1873 K) не обозначена [ЖФХ, 1994, Т.337, №6,
С.775-778)]
При изменении атомной доли кремния в группировках (ассоциатах) [FexSiy] наблюдаются немонотонные зависимости с максимумами их концентраций при определенных атомных соотношениях кремния и железа. Причем термодинамическая устойчивость группировок (ассоциатов, кластеров) различна и она принята пропорциональной максимальной концентрации кластеров. Для 1600оС термодинамическая прочность кластеров [FeSi], [Fe3Si], [FeSi2] и [Fe5Si3] соотносится как 17,2 : 6,6 : 1,9 : 1,0 соответственно. Наиболее термодинамически устойчивыми (прочными) являются кластеры конгруэнтно плавящегося (без разложения) химического соединения (моносилицида) FeSi.
Активность кремния в расплавах системы Fe–Si увеличивается с ростом концентрации кремния, что иллюстрируется данными рис. 5.3. С повышением активности кремния снижается активность железа. Пересечение линий аSi и aFe соответствует атомной концентрации кремния в сплаве 0,48, а не эвтектическому составу.
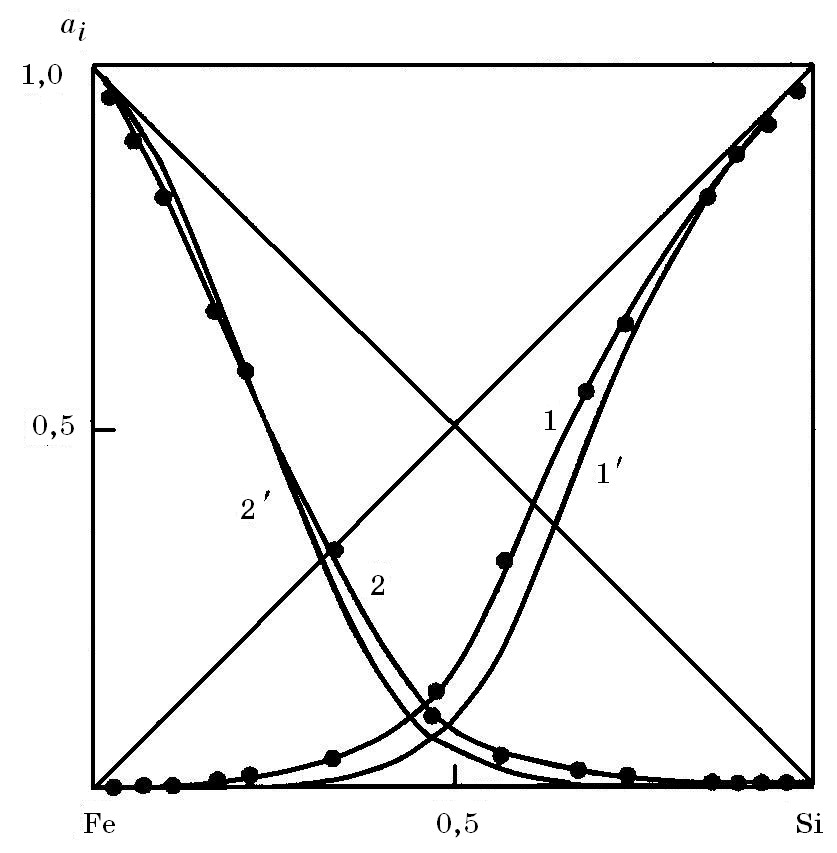
Рис. 5.3. Активности кремния аSi и aSi′ и железа аFe и aFe′ и в растворах системы Fe–Si при 1600оС; аSi и aFe – расчетные; aSi′ и aFe′ - экспериментальные данные
А.И.Зайцев и др.* рассчитали термодинамические функции ∆G![]() (Т) реакций образования силицидов железа по следующим уравнениям (в Дж/моль):
(Т) реакций образования силицидов железа по следующим уравнениям (в Дж/моль):
∆G![]() (Fe2Si) = –129028 + 2,52T,
(Fe2Si) = –129028 + 2,52T,
∆G![]() (FeSi) = –163132 + 1,79T,
(FeSi) = –163132 + 1,79T,
∆G![]() (FeSi2) = –121842 + 7,18T.
(FeSi2) = –121842 + 7,18T.
Изменение интегральной и парциальной избыточных энергий Гиббса расплавов системы Fe–Si в зависимости от мольной концентрации кремния приведены на рис. 5.4.
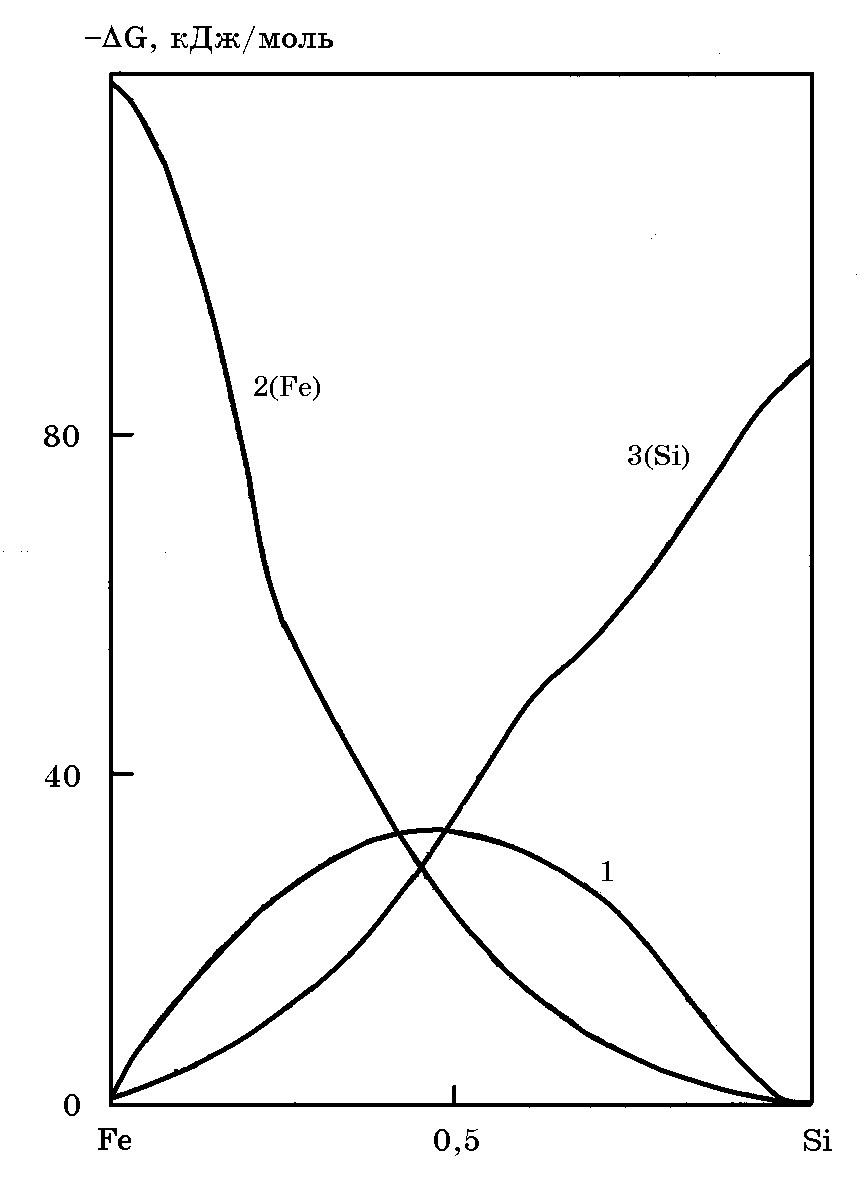
Рис. 5.4. Интегральная 1 и парциальная 2(Fe), 3(Si) избыточные энергии Гиббса растворов системы Fe-Si при 1600оС
Данные рис. 5.4 подтверждают, что кремний с железом образуют термодинамически прочные соединения (силициды в твердом состоянии) и ассоциаты (в жидком состоянии), что сопровождается снижением активности кремния в промышленном ферросилиции и улучшает термодинамические условия восстановления кремния из кремнезема углеродом в присутствии железа.
Система Fe–Si–C (рис. 5.5). Растворимость углерода в чистом железе зависит температуры [%C]Fe = 1,30 + 2,5×103t, oС. Процесс растворения графита в железе характеризуется изменением энергии Гиббса:
Сграф → [C]Fe; ∆G![]() = 21354 – 41,87Т,Дж/моль.
= 21354 – 41,87Т,Дж/моль.
Добавление кремния в насыщенный железоуглеродистый расплав уменьшает растворимость в нем углерода по сложной зависимости. В интервале концентраций кремния 0—23,18% Si связь [%C] = f[%Si] близка к прямолинейной (рис.5.5).При содержании кремния, соответствующем силициду Fe5Si3, на кривой отмечен изгиб. С дальнейшим увеличение концентрации кремния в сплаве участок кривой асимптотически приближается к оси концентраций кремния. Сплавы с 0—23,18% Si находятся в равновесии с чистым графитом, а при более высоком содержанием кремния — с карбидом кремния.
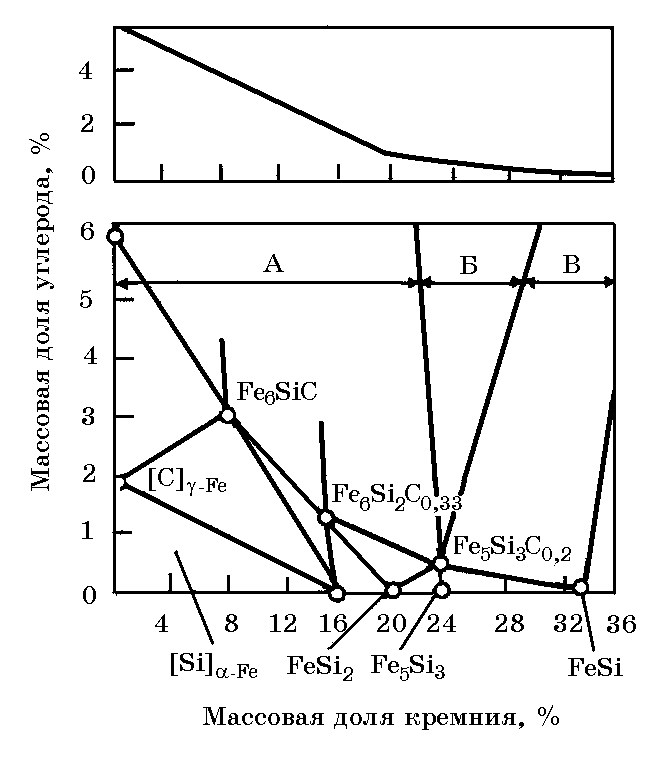
Рис. 5.5. Влияние массовой концентрации Si на растворимость углерода в сплавах Fе–Siнас, равновесных с графитом (область А), графитом и карбидом кремния (область Б), карбидом кремния (область В), при 1760оС
Влияние кремния на растворимость углерода в сплавах системы Fе–Si отражено в стандартах на ферросилиций (см.табл. 5.1…5.4). Растворимость углерода в сплавах системы Fe–Si растет с увеличением температуры. Выпускаемые из печи сплавы различных марок имеют сравнительно высокую температуру (1600–1800оС). В процессе понижения температуры сплава в ковше в жидком ферросилиции уменьшается растворимость углерода, что приводит к выделению графита (спели) в сплавах, в которых содержится до 22–24% Si, или карбида кремния в сплавах с содержанием кремния более 22–24%. Для улучшения условий всплывания выделяющихся частиц графита или карбида кремния жидкий ферросилиций выдерживают в ковше перед разливкой.