Используя табличные стандартные значения термодинамических констант веществ (теплоты химических реакций образования соединений (оксидов) из компонентов ∆Н
Поскольку функция ∆G
1.2 Термодинамика реакций образования оксидов |
Содержание > Глава 1. Физико-химические основы ферросплавных процессов > 1.2.Термодинамика реакций образования оксидов
Ферросплавы получают, используя в качестве шихтовых материалов кислородные соединения ферросплавных элементов, т.е. руд и концентратов, в которых элементы (металлы) содержатся в виде оксидов (оксидных минералов). При поступлении на ферросплавный завод сульфидного концентрата молибдена, он обязательно предварительно подвергается окислительному обжигу для перевода сульфида молибдена (МоS2) в оксиды МоО2 и МоО3. Обжигу подвергаются также и карбонатные виды сырья (известняк, манганокальцитовые марганцевые концентраты). При выплавке силикокальция в электропечь загружают шихту, содержащую СаСО3 или известь (СаО), которую получают предварительным обжигом известняка. Поэтому при термодинамическом анализе восстановительных реакций, происходящих в ваннах ферросплавных электропечей, рассматривают реакции взаимодействия оксидов с восстановителем (углеродом, кремнием или алюминием).
Используя табличные стандартные значения термодинамических констант веществ (теплоты химических реакций образования соединений (оксидов) из компонентов ∆Н![]() , теплоты фазовых переходов элементов и химических соединений ∆Нпр, энтропии элементов и химических соединений S
, теплоты фазовых переходов элементов и химических соединений ∆Нпр, энтропии элементов и химических соединений S![]() , изменение энтропии при фазовых переходах и химических реакциях), можно получить зависимость ∆G
, изменение энтропии при фазовых переходах и химических реакциях), можно получить зависимость ∆G![]() (Т) для реакций взаимодействия элементов с молекулярным кислородом для широкого интервала температур.
(Т) для реакций взаимодействия элементов с молекулярным кислородом для широкого интервала температур.
Поскольку функция ∆G![]() = ∆Н
= ∆Н![]() – ∆S
– ∆S![]() Т, имеет вид прямой (уравнение у = b— kх), в точках фазовых переходов функции ∆G
Т, имеет вид прямой (уравнение у = b— kх), в точках фазовых переходов функции ∆G![]() (T)наблюдаются изломы. Зависимость ∆G
(T)наблюдаются изломы. Зависимость ∆G![]() (T) имеет вид ломаной линии, что показано для некоторых реакций на диаграмме, которая называется диаграммой химического сродства элементов к кислороду (рис. 1.1).
(T) имеет вид ломаной линии, что показано для некоторых реакций на диаграмме, которая называется диаграммой химического сродства элементов к кислороду (рис. 1.1).
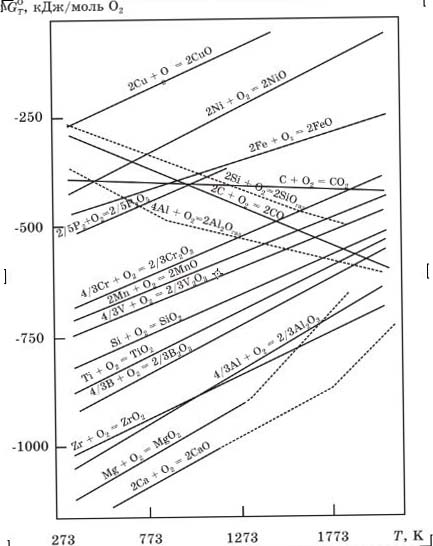
Рис. 1.1. Диаграмма химического сродства элементов к кислороду
Физико-химическая интерпретация графического представления функции ∆G![]() (T) для реакций в системах элемент—кислород позволяет отметить несколько принципиальных заключений. С увеличением числа валентных электронов изолированного атома элемента снижается термодинамическая прочность оксида (рис. 1.2.).
(T) для реакций в системах элемент—кислород позволяет отметить несколько принципиальных заключений. С увеличением числа валентных электронов изолированного атома элемента снижается термодинамическая прочность оксида (рис. 1.2.).

Рис. 1.2. Зависимость термодинамической прочности оксидов элементов от числа валентных электронов изолированного атома элемента
Чем меньше значение ∆G![]() (∆G
(∆G![]() <0), тем больше химическое сродство элемента к кислороду; условия ∆G
<0), тем больше химическое сродство элемента к кислороду; условия ∆G![]() = 0 — означает равновесие реакции взаимодействия различного элемента к кислороду и при ∆G
= 0 — означает равновесие реакции взаимодействия различного элемента к кислороду и при ∆G![]() >0 — термическую диссоциацию оксида.
>0 — термическую диссоциацию оксида.
1. Анализ положения на диаграмме линий ∆G![]() (T)свидетельствует, что все элементы имеют различное химическое сродство к кислороду. По увеличению термодинамической прочности образующихся оксидов элементы располагаются в ряд (при 1600оС): Сu, Ni, Со, W, Мо, Fе, Р, Сr, Мn, V, Nb, Si, Тi, В, А1 Zr, Мg, Са. Излом на прямых ∆G
(T)свидетельствует, что все элементы имеют различное химическое сродство к кислороду. По увеличению термодинамической прочности образующихся оксидов элементы располагаются в ряд (при 1600оС): Сu, Ni, Со, W, Мо, Fе, Р, Сr, Мn, V, Nb, Si, Тi, В, А1 Zr, Мg, Са. Излом на прямых ∆G![]() (T) имеет место при температурах фазовых переходов.
(T) имеет место при температурах фазовых переходов.
2. Химическое сродство элементов к кислороду с повышением температуры снижается, т.е., чем выше температура, тем ниже термодинамическая прочность оксидов.
3. Химическое сродство углерода к кислороду по реакции 2С + О2 = 2СО с образованием газообразного оксида СО с повышением температуры повышается, а не снижается, как это характерно для большинства других элементов. При взаимодействии твердого углерода с молекулярным кислородом с образованием СО2 термодинамическая прочность оксида СО2 слабо зависит от температуры.
4. Точка пересечения линии ∆G![]() (T)определенного элемента с линией ∆G= 0, соответствует температуре равновесия реакции взаимодействия элемента с кислородом.
(T)определенного элемента с линией ∆G= 0, соответствует температуре равновесия реакции взаимодействия элемента с кислородом.
5.Температуру, соответствующую ∆G![]() = 0, условно принимают за температуру начала термической диссоциации оксида. Для большинства оксидов эти температуры превышают несколько тысяч градусов. Это является одной из главных причин, почему ферросплавные элементы (ферросплавы) не получают простым нагреванием оксидов, а все ферросплавные процессы основываются на восстановлении элементов из их оксидов соответствующими восстановителями (углеродом, кремнием или алюминием).
= 0, условно принимают за температуру начала термической диссоциации оксида. Для большинства оксидов эти температуры превышают несколько тысяч градусов. Это является одной из главных причин, почему ферросплавные элементы (ферросплавы) не получают простым нагреванием оксидов, а все ферросплавные процессы основываются на восстановлении элементов из их оксидов соответствующими восстановителями (углеродом, кремнием или алюминием).
6. Точка пересечения линии ∆G![]() (T)углерода для реакции С + О2 = 2СО с линией ∆G
(T)углерода для реакции С + О2 = 2СО с линией ∆G![]() (T)соответствующего элемента означает равенство химического сродства углерода и данного элемента к кислороду. Повышение температуры способствует росту химического сродства углерода к кислороду и,наоборот, снижению сродства соответствующего элемента к кислороду. В этом аспекте углерод является “универсальным” восстановителем, способным восстановить любой элемент из его оксида, если будут созданы необходимые температурные условия.
(T)соответствующего элемента означает равенство химического сродства углерода и данного элемента к кислороду. Повышение температуры способствует росту химического сродства углерода к кислороду и,наоборот, снижению сродства соответствующего элемента к кислороду. В этом аспекте углерод является “универсальным” восстановителем, способным восстановить любой элемент из его оксида, если будут созданы необходимые температурные условия.
7. Положение углерода в приведенном выше ряду химического сродства элементов к кислороду определяется температурой. При низких температурах углерод занимает крайнее левое положение, а при высоких — крайнее правое. При повышении температуры углерод будет постепенно перемещаться слева направо, занимая промежуточное положение между элементами в приведенном ряду.
8. Сравнение положений линий трех элементов-восстановителей, используемых в производстве ферросплавов (С, Si и Аl), показывает, что при умеренных температурах алюминий и кремний характеризуются большей восстановительной способностью, чем углерод. Однако при высоких температурах более сильным восстановителем является углерод.
Эти основные положения, вытекающие из анализа диаграммы химического сродства элементов к кислороду, помогают выяснить другие особенности окислительно-восстановительных процессов, имеющих место в ферросплавных печах при выплавке ферросплавов и их рафинировании от вредных примесей.
В некоторых учебниках и учебных пособиях положение линий углерода (окисление его до СО и СО2) не находит физико-химического объяснения, а обычно трактуется «универсальностью» свойств углерода. Такая «фетишизация» углерода побудила необходимость раскрыть сущность этого «парадокса» и показать, что в этом аспекте углерод не является исключением, а наиболее типичный пример хорошо известного в физической химии положения о характере функции ∆G![]() (T)реакций с участием конденсированных и газообразных компонентов (веществ). Обратимся к аналитическому исследованию функции ∆G
(T)реакций с участием конденсированных и газообразных компонентов (веществ). Обратимся к аналитическому исследованию функции ∆G![]() = ∆Н
= ∆Н![]() – – ∆S
– – ∆S![]() Т. В случае реакции окисления элементов кислородом величина ∆Н
Т. В случае реакции окисления элементов кислородом величина ∆Н![]() всегда имеет отрицательное значение (–∆Н
всегда имеет отрицательное значение (–∆Н![]() = +Q
= +Q![]() ), поскольку окисление сопровождается выделением тепла. Следовательно, положение (наклон) прямой ∆G
), поскольку окисление сопровождается выделением тепла. Следовательно, положение (наклон) прямой ∆G![]() (T) на диаграмме определяется величиной ∆S
(T) на диаграмме определяется величиной ∆S![]() и знаком при ней.
и знаком при ней.
Изменение энтропии реакции взаимодействия элементов с кислородом рассчитывается как алгебраическая сумма энтропии продуктов реакции минус сумма энтропии исходных компонентов. Известно, что энтропии газообразных веществ (оксидов О2, СО2, СО, SiOгаз, Al2Oгаз) значительно выше энтропии конденсированных веществ (Ств, Siтв, SiO2тв, Alтв, Al2O3г).Расчеты показывают, что для реакций, сопровождающихся увеличением количества молей газообразных веществ, как это наблюдается при реакции 2С + О2 = 2СО, изменение энтропии ∆S![]() всегда будет со знаком плюс. Тогда в выражении ∆G
всегда будет со знаком плюс. Тогда в выражении ∆G![]() (Т)= ∆Н
(Т)= ∆Н![]() – ∆S
– ∆S![]() Т оба слагаемых будут со знаком «минус». Поэтому повышение температуры приводит к уменьшению ∆G
Т оба слагаемых будут со знаком «минус». Поэтому повышение температуры приводит к уменьшению ∆G![]() , т.е. повышению термодинамической прочности оксида СО. В случае реакции С + О2= СО2 количество молей газообразных веществ не изменяется и поэтому реакция слабо зависит от температуры.
, т.е. повышению термодинамической прочности оксида СО. В случае реакции С + О2= СО2 количество молей газообразных веществ не изменяется и поэтому реакция слабо зависит от температуры.
Если взаимодействие других элементов с молекулярным кислородом протекает в условиях, когда возможно образование газообразных оксидов (SiОгаз, Аl2Огаз и др.), повышение температуры способствует повышению термодинамической прочности этих оксидов. Выше приведенные положения иллюстрируются расчетными данными.
Условия задачи. Используя табличные данные, составить уравнение ∆G![]() (T)для следующих реакций:
(T)для следующих реакций:
(А) 2Ств + О2газ = 2СОгаз
(Б) Ств+ О2газ = СО2газ
(В) Siтв + О2газ = SiO2тв
(Г) 2Siтв+О2газ = 2SiОгаз
(Д) 2Сатв + О2газ = 2СаОтв
и проанализировать влияние температуры на условия образования оксидов (термодинамическую прочность оксидов).
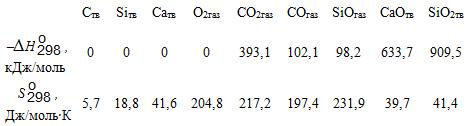
Табличные значения ∆Н ![]() и S
и S ![]() для участвующих в реакции компонентов следующие:
для участвующих в реакции компонентов следующие:
Изменение энтальпии реакции (А)равно:
∆Н![]() (А)= 2∆Н
(А)= 2∆Н![]() (СОгаз) – 2∆Н
(СОгаз) – 2∆Н![]() (Ств) – ∆Н
(Ств) – ∆Н![]() (О2) =
(О2) =
= –2∙102,1 = –204,2 кДж/моль.
Изменение энтропии реакции (А) равно
∆S![]() = 2S
= 2S![]() (СОгаз) – 2S
(СОгаз) – 2S![]() (Ств) – S
(Ств) – S![]() (О2газ) =
(О2газ) =
= 2∙197,4 – 2∙5,7– 204,8 = +178,6, Дж/(моль∙K).
Выполнив соответствующие расчеты и для остальных реакций, получим выражение ∆G![]() (T)для всех реакций (А)–(Д) в Дж/моль О2:
(T)для всех реакций (А)–(Д) в Дж/моль О2:
∆G![]() (А)= –204200 – 178,6Т;
(А)= –204200 – 178,6Т;
∆G![]() (Б)= –393100 – 6,7Т;
(Б)= –393100 – 6,7Т;
∆G![]() (В) = –909500 +182,2Т;
(В) = –909500 +182,2Т;
∆G![]() (Г)= –196400 – 221,4Т;
(Г)= –196400 – 221,4Т;
∆G![]() (Д)= –1267400 +208,6Т.
(Д)= –1267400 +208,6Т.
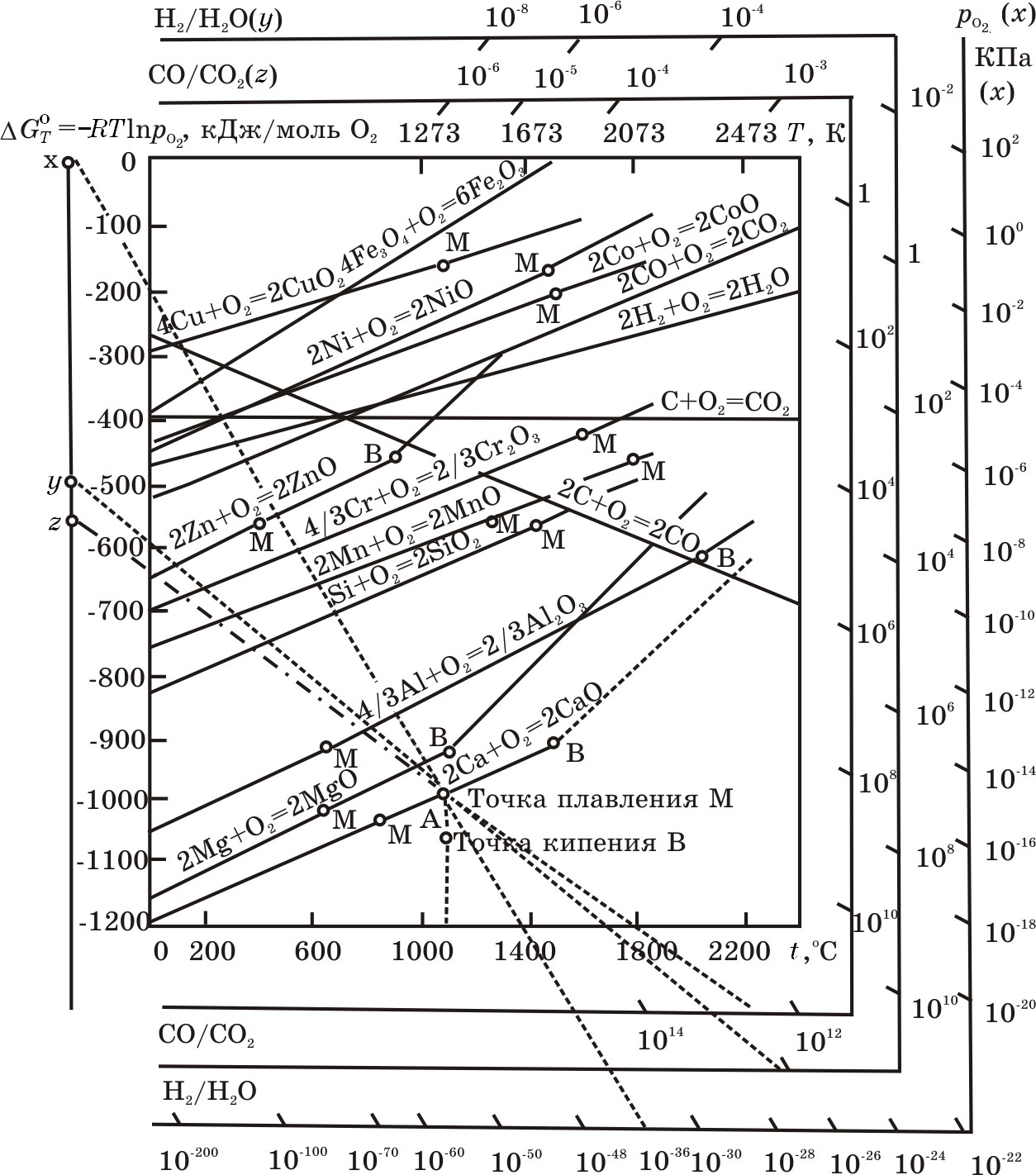
Рис. 1.3. Диаграммы Эллингема—Ричардсона—Джеффеза для равновесий металл — оксид металла: точки М и В – температуры фазовых превращений элементов
Функциональную зависимость ∆G![]() (T)реакции (А)достаточно наглядно можно интерпретировать графически, представив функцию ∆G
(T)реакции (А)достаточно наглядно можно интерпретировать графически, представив функцию ∆G![]() (T)в координатах Т—∆Go(см. рис. 1.3). По положению линий, характеризующих изменение энергии Гиббса реакций образования оксидов, можно оценивать возможность и направленность любой реакции. Этот общепринятый вид графического представления функции ∆G
(T)в координатах Т—∆Go(см. рис. 1.3). По положению линий, характеризующих изменение энергии Гиббса реакций образования оксидов, можно оценивать возможность и направленность любой реакции. Этот общепринятый вид графического представления функции ∆G![]() (T)Ф. Ричардсон и Д. Джеффез дополнили номографическими шкалами (рис.1.3), позволяющими находить графо-аналитическим методом упругость диссоциации pO2 оксида и равновесные соотношения Н2/Н2О и СО/СО2 в газовых смесях для заданных температур. Процедура нахождения искомых величин pO2, Н2/Н2О и СО/СО2 заключается в следующем. На номографической вертикальной линии, находящейся слева диаграммы, указаны три точки х, у и z. На трех шкалах справа диаграммы указаны численные значения pO2(шкала х), отношения Н2/Н2О (шкала у) и СО/СО2 (шкала z). Определение искомой величины pO2для реакции термической диссоциации оксида, например СаО, ведут следующим образом.
(T)Ф. Ричардсон и Д. Джеффез дополнили номографическими шкалами (рис.1.3), позволяющими находить графо-аналитическим методом упругость диссоциации pO2 оксида и равновесные соотношения Н2/Н2О и СО/СО2 в газовых смесях для заданных температур. Процедура нахождения искомых величин pO2, Н2/Н2О и СО/СО2 заключается в следующем. На номографической вертикальной линии, находящейся слева диаграммы, указаны три точки х, у и z. На трех шкалах справа диаграммы указаны численные значения pO2(шкала х), отношения Н2/Н2О (шкала у) и СО/СО2 (шкала z). Определение искомой величины pO2для реакции термической диссоциации оксида, например СаО, ведут следующим образом.
Первоначально на шкале температур откладываем интересующую температуру (принимаем 1273 К) и проводим вертикальную линию до пересечения ее с характерной линией для реакции 2Са + О2 = 2СаО. Обозначим точку пересечения этих двух линий А. Затем через точки х и А проводим прямую до пересечения со шкалой pO2(шкала х). Указанная на этой шкале величина pO2 и будет упругостью диссоциации оксида, равная 10–34 кПа. Для нахождения отношения Н2/Н2О в газовой смеси, соответствующего упругости диссоциации pO2= 10–34 кПа, через точки у и А проводим прямую до пересечения со шкалой Н2/Н2О (шкала у). Получаем, что упругости диссоциации СаО pO2= 10–34 кПа соответствует отношению Н2:Н2О = 1012. Следовательно, даже незначительное количество Н2О в газовой смеси характеризуют ее как весьма окислительную, приводящую к окислению металлического кальция до СаО. Процедура определения соотношения СО/СО2 аналогична предыдущей с той лишь разницей, что прямую проводим через точки z и А до пересечения со шкалой СО/СО2 (шкала z). Найденное отношение СО/СО2, соответствующее упругости диссоциации оксида СаО pO2 = 10–34 кПа.
Таким образом, диаграмма Эллингема—Ричардсона—Джеффеза позволяет графическим методом определить упругость диссоциации оксида, образующегося по приведенным на ней реакциям, а также найти отношения Н2/Н2О и СО/СО2, соответствующие конкретному значению упругости диссоциации каждого оксида при заданной температуре.