7.1 Свойства хрома и его соединений |
Содержание > ГЛАВА 7. Электрометаллургия хромовых ферросплавов > 7.1 Свойства хрома и его соединений
Хром – элемент IVb группы Периодической системы элементов Д.И.Менделеева. Порядковый номер 24, электронная конфигурация 3d54s1, атомная масса 51,996; температура плавления 1870оС и температура кипения 2469оС, плотность 7,19 г/см3; валентность в стабильном состоянии 2, 3 и 6. Хром не обладает аллотропией*.
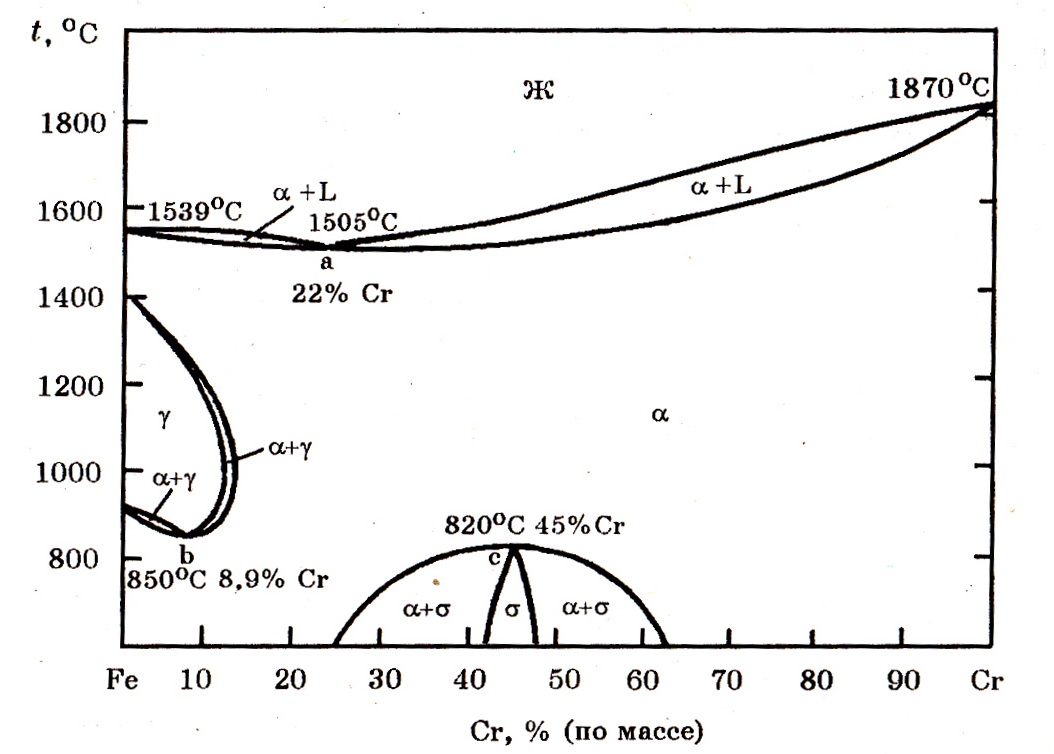
Система Cr–Fe (рис. 7.1). Хром с железом образует непрерывный ряд твердых и жидких растворов. Для сплава 30% Fe + 70% Cr температура солидус составляет 1580оС, а ликвидус 1640оС. Область γ-фазы полностью замыкается при 13% Сr.

Рис.7.1. Диаграмма равновесного состояния системы Fe–Cr
При t ≤ 820оС в интервале 25–65% Сr существует твердая и хрупкая σ-фаза.
Система Cr–C(рис. 7.2 и 7.3). Хром с углеродом образует карбиды Cr23C6; Cr7C23 и Cr3C2 с 5,58, 13,3 и 9,0% С соответственно, по новым данным и CrC с 18,75% С.
Монокарбид CrC в системе Cr–C стабилен в интервале 1500 – 2100 K, энтальпия образования карбида ∆Н![]() = –10,9 кДж/моль.
= –10,9 кДж/моль.
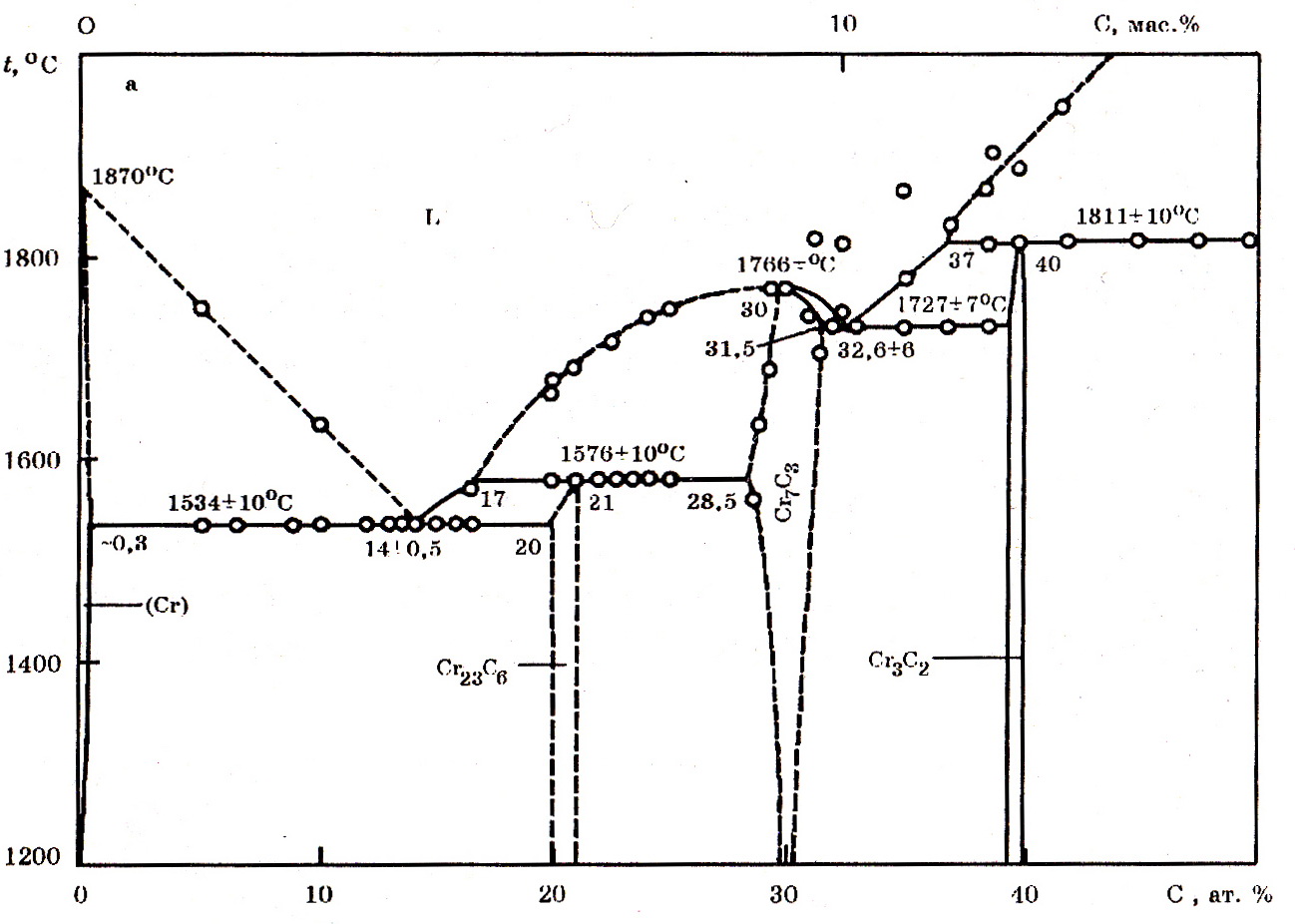
Рис. 7.2. Диаграмма равновесного состояния системы Cr–С
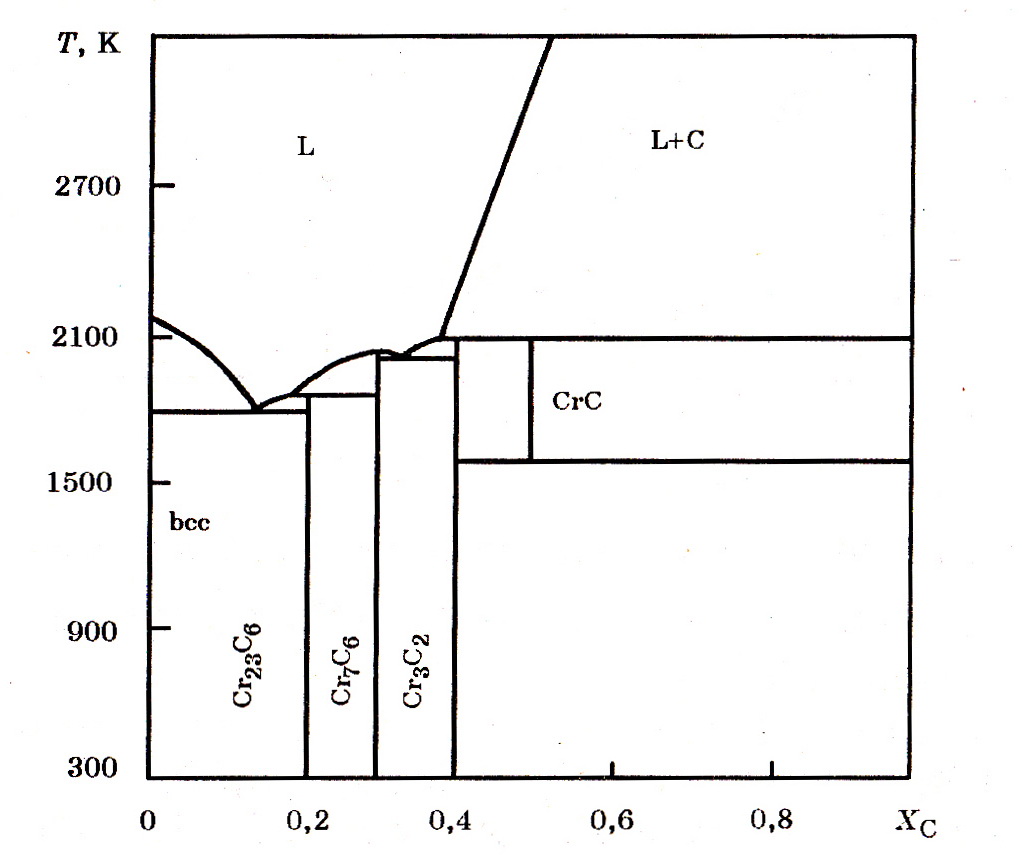
Рис. 7.3. Диаграмма равновесного состояния системы Cr–C
с наличием карбида CrC
В интервале 1500–2000 K для приведенных ниже реакций применимы следующие зависимости ∆G![]() (Т):
(Т):
23Cr(т) + 6C(т)= Cr23C6(т); ∆G
= –411480–38,55Т, Дж/моль;
7Cr(т) +3C(т) = Cr7C3(т); ∆G= –188790 – 18,54Т, Дж/моль;
3Cr(т) + 2C(т) = Cr3C2(т); ∆G= –89999 – 17,2Т, Дж/моль
Углерод растворяется в твердом хроме в небольших количествах. Зависимость растворимости углерода в хроме от температуры определяется по уравнению:
lg[C] = –9887/T = 4,3 (973-1673 K).
Система Cr–Fe–C(рис. 7.4). В этой системе существуют следующие фазы: a-твердый раствор углерода в хроме (МК), карбиды (Cr, Fe)23C6; (Cr, Fe)7C3; (Cr, Fe)3C2 и интерметаллид FeCr (σ-фаза).
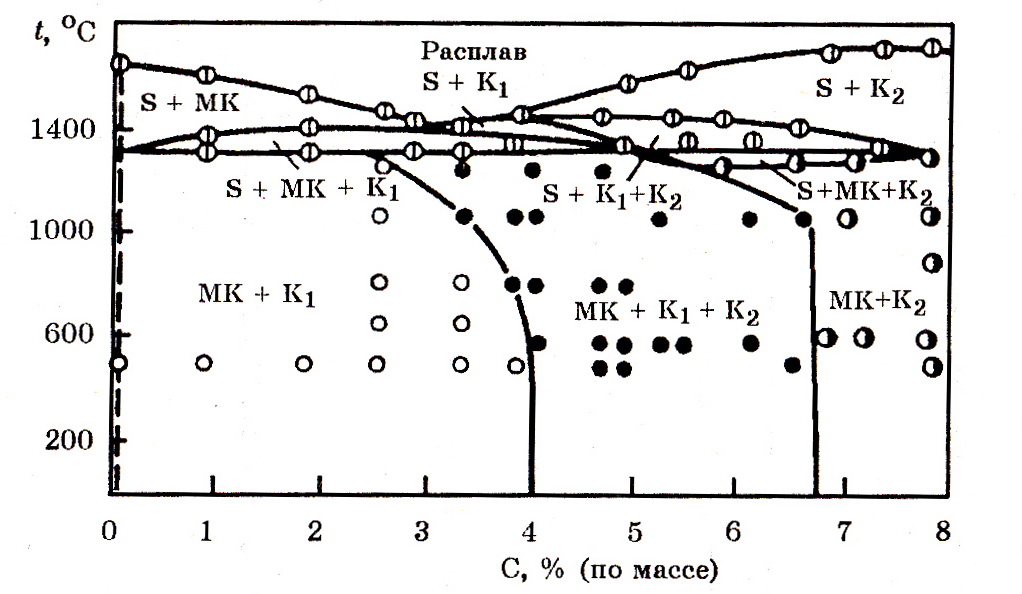
Рис.7.4. Изоконцентрационные сечения диаграммы Cr–Fe–C при 70% Cr
(без указания сигма-фазы)
(S – расплав; К1 – Ме23С8; К2 – Ме7С3; МК – твердый раствор С в Cr)
С повышением концентрации углерода в системе 70% Cr–Fe–C температура ликвидус снижается с 1640оС при 0% С до 1400оС при 3-3,2% С, а затем повышается и при 8% С достигает 1700оС.
Система Cr–Si (рис. 7.5). В системе Cr–Si образуются термодинамически прочные силициды Cr3Si, Cr5Si3, CrSi и CrSi2 (табл. 7.1). Силициды Cr3Si и Cr5Si3 плавятся конгруэнтно при 1770оС и 1720оС соответственно, а CrSi инконгруэнтно при 1475оС. При такой же температуре конгруэнтно плавится силицид CrSi2. Первые парциальные энтальпии смешения хрома с жидким кремнием ∆Н ∞Cr= –82,0 и кремния с жидким хромом ∆Н ∞Si = –135,0 кДж/моль.
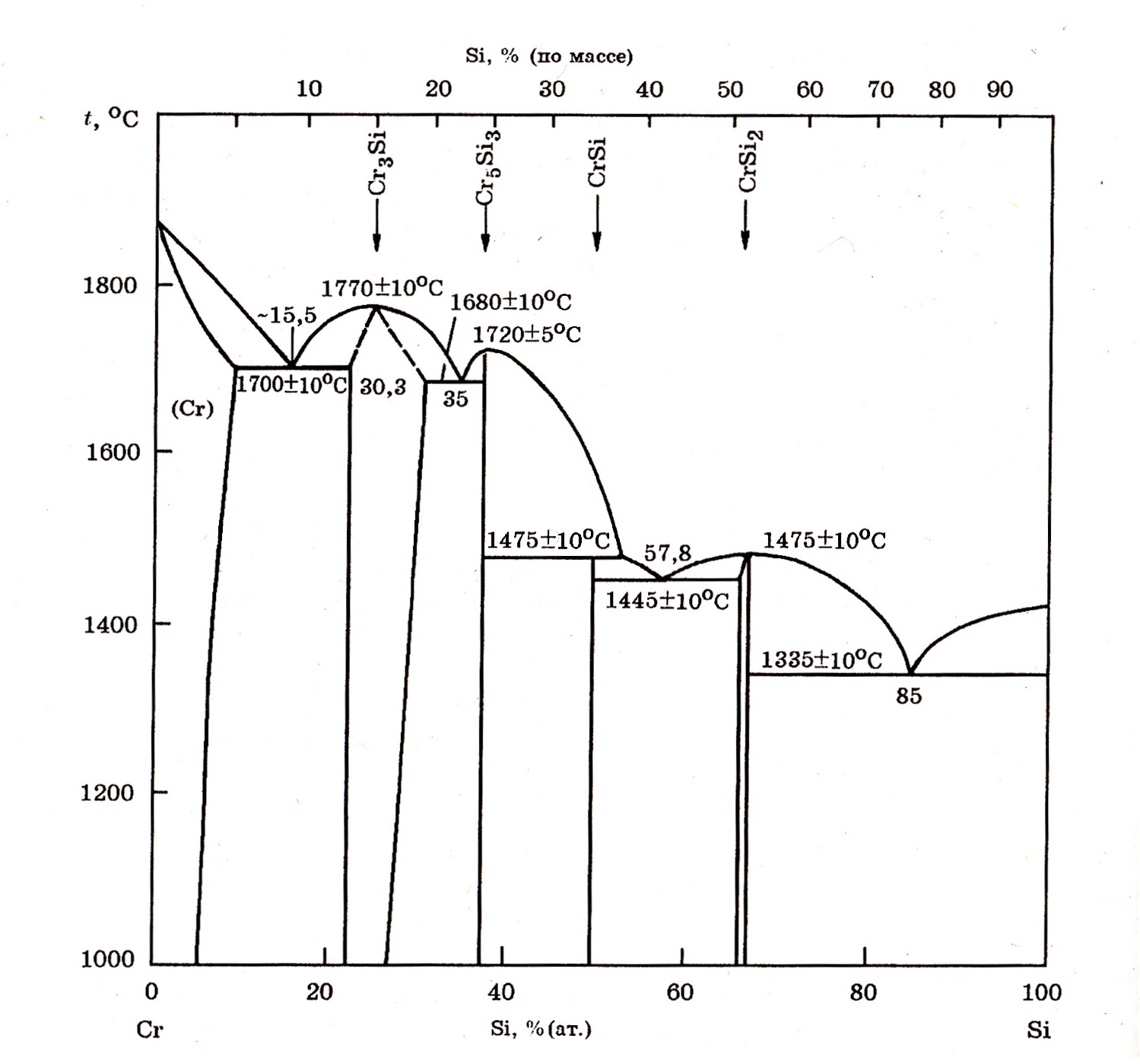
Рис. 7.5. Фазовые равновесия в системе Cr–Si
В тройной системе Cr-Fe-Si образуются железохромистые силициды (Cr, Fe)3Si; (Cr, Fe)5Si3; (Cr, Fe)Si2.
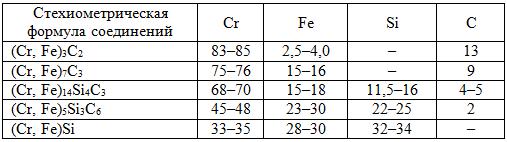
Система Cr–Si–C (рис.7.6). Структурными составляющими в системе Cr–Si–C являются твердый раствор кремния и углерода в хроме, карбиды Cr23C6, Cr7C3 и Cr3C2; силициды Cr3Si, Cr5Si3, CrSi, CrSi2; α- и β-модификации SiC и тернарное силикокарбидное соединение Cr5Si3Cx (фаза Новотного). В тернарной системе Cr–Fe–Si–C образуются сложные силикокарбиды (табл. 7.2).
Таблица 7.1. Некоторые свойства силицидов железа и хрома
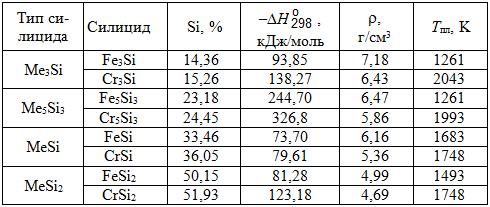
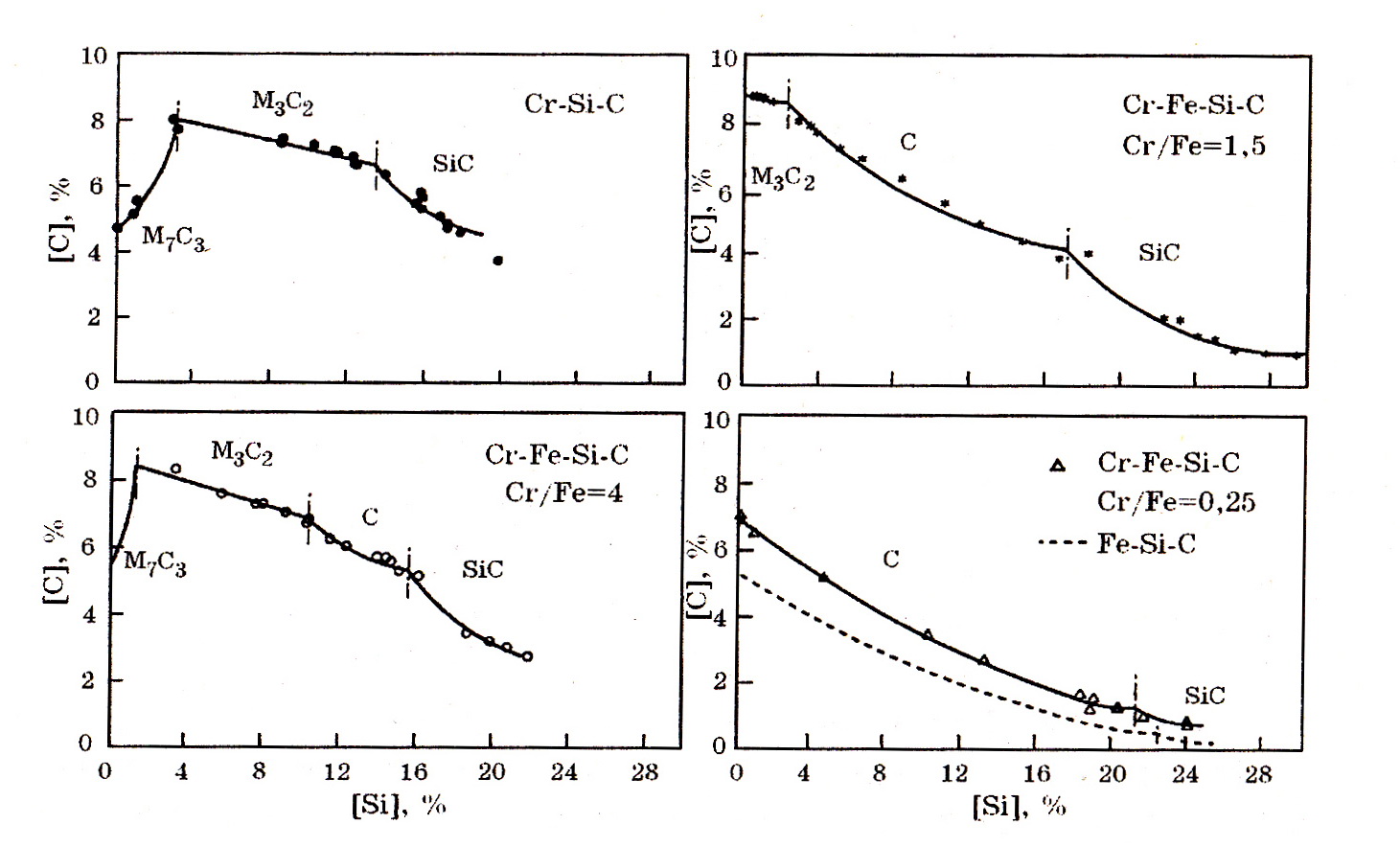
Рис. 7.6. Кремне-углеродные соотношения в системе Cr–Fe–Si–C при
температуре 1600оС*
Таблица 7.2. Химический состав, %, соединений в системе Cr–Fe–Si–C
Система Cr–P. (рис. 7.7) В системе образуются фосфиды Cr3P, Cr2P, CrP, CrP2 и др. В твердом хроме фосфор растворяется в небольших количествах и при кристаллизации сплавов выделяется в виде фосфидов. Уравнения для расчета изменения энергии Гиббса реакций образования Cr3P и Cr2P в интервале 1350-1680 K имеют вид:
3Cr(т) + 1\2P2 = Cr3P, ∆G![]() = –252660 + 193,8Т, Дж/моль;
= –252660 + 193,8Т, Дж/моль;
2Cr(т) + 1\2P2 = Cr2P, ∆G![]() = –228360 + 153,98Т, Дж/моль.
= –228360 + 153,98Т, Дж/моль.
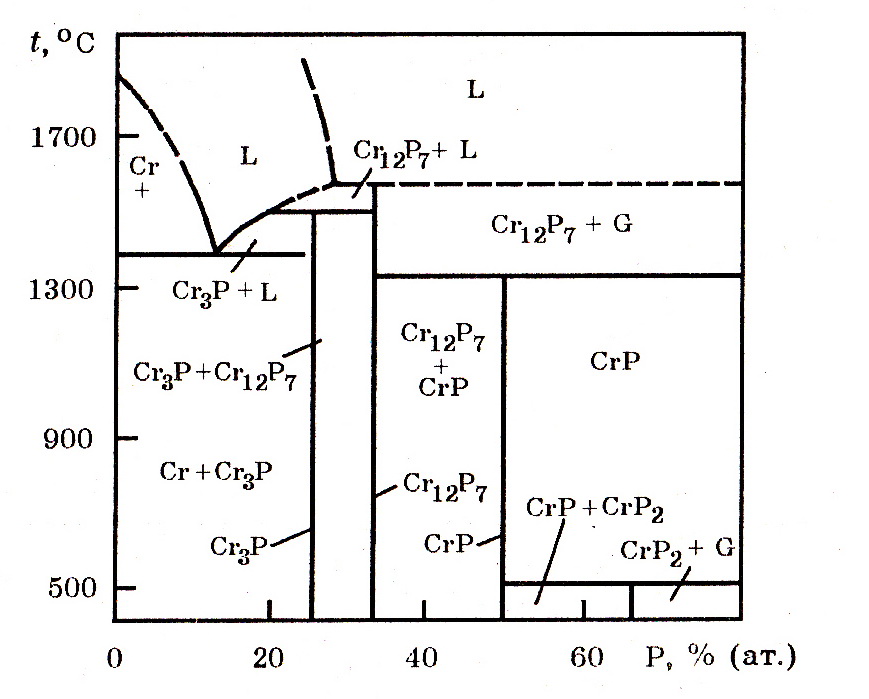
Рис. 7.7. Изобарные сечения диаграммы состояния Cr–P
при давлении 1 кПа
Хром с фосфором образует более прочные, чем железо, фосфиды. Поэтому дефосфорация сплавов хрома окислительным способом (подобно удалению фосфора из стальной ванны) малоэффективна.
Система Cr–S. Существуют стабильные сульфиды CrS, Cr3S4 и Cr2S3, а также метастабильные Cr7S8 и Cr3S6. Изменение энергии Гиббса реакции образования моносульфида из элементов в зависимости от температуры (1375–1507 K) описывается выражением (Дж/моль) ∆G![]() (CrS) = –202312 +56,0Т.
(CrS) = –202312 +56,0Т.
Система Cr–O (рис. 7.8). Известны оксиды CrO3, Cr2O3, Cr3O4, CrO. В области указанных на рис. 7.8 температур и парциальных давлений кислорода может существовать Cr2O3 и Cr3O4; причем Cr3O4 в очень узком температурном интервале 1650–1705оС.
Температурные зависимости изменения энергии Гиббса реакций образования Cr2O3 и CrO имеют вид:
2Cr + 3/2О2 = Cr2О3, ∆G![]() = –1153703 + 275,2Т, Дж/моль;
= –1153703 + 275,2Т, Дж/моль;
2Cr + О2 = 2CrО, ∆G![]() = –516552 + 384,9Т, Дж/моль.
= –516552 + 384,9Т, Дж/моль.
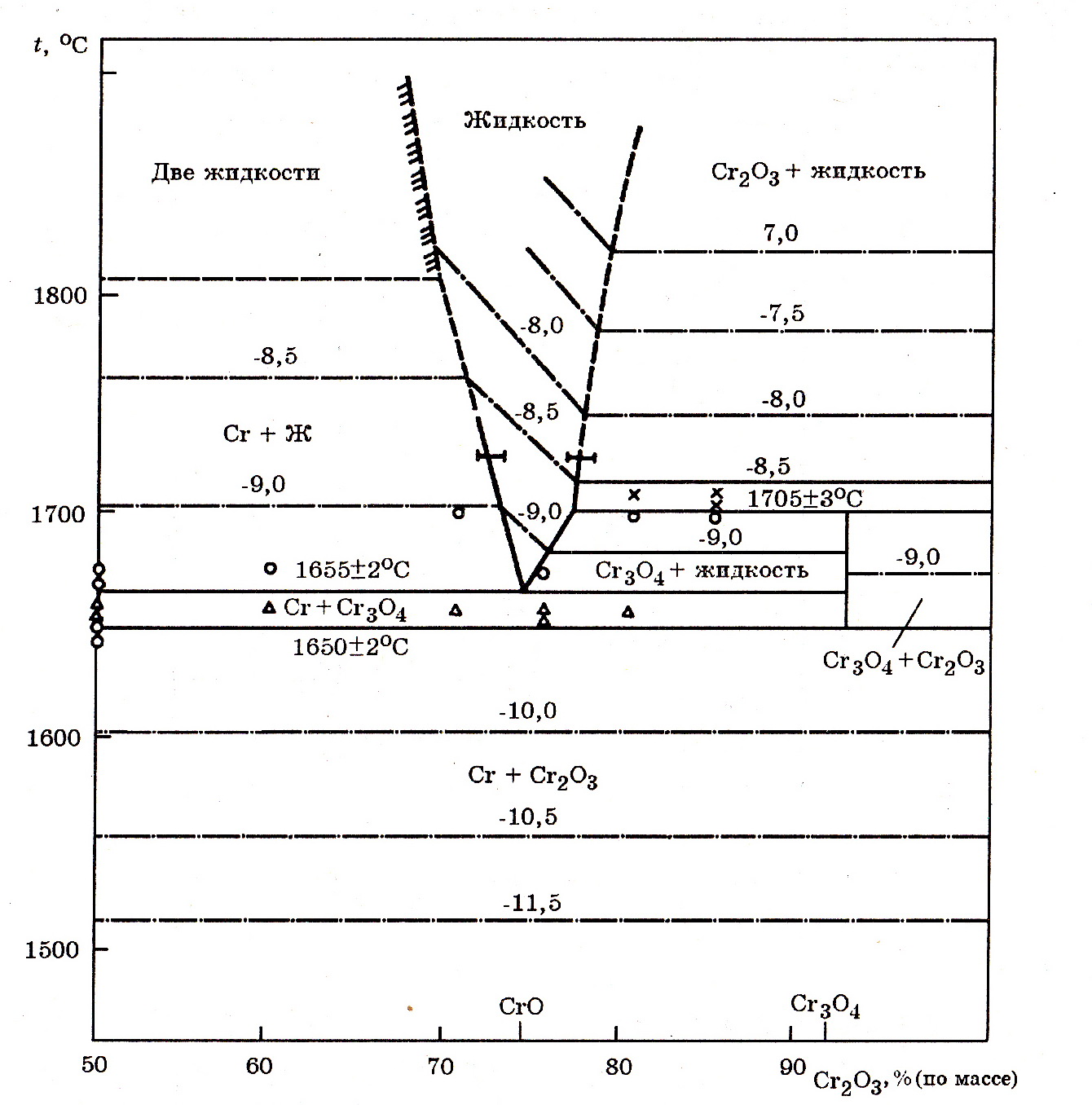
Рис. 7.8. Фазовые равновесия в части системы Cr–Cr2O3; штрихпунктирные линии – логарифм давления диссоциации оксидов (рO2, кПа)
Система СаО–Cr2O3(рис. 7.9). В системе образуются хромитохромат кальция 9СаО∙4CrO3∙Cr2O3 с tпл = 1774оС и хромат СаCrO4, распадающийся по перитектической реакции. Особенно прочным соединением в системе является хромат кальция СаО∙Cr2O3. В окислительных условиях в системе СаО–Cr2О3 образуется ряд легкоплавких составов. Эту особенность системы используют для получения расплава оксида хрома Cr2O3 с известью при выплавке силикотермического феррохрома методом смешения рудно-известкового расплава с ферросиликохромом вне печи, известково-хромистого расплава при алюминотермическом методе производства феррохрома и т.д. При содержании 30–60% Cr2O3 температура ликвидуса в системе СаО–Cr2O3 не превышает 1773оС.
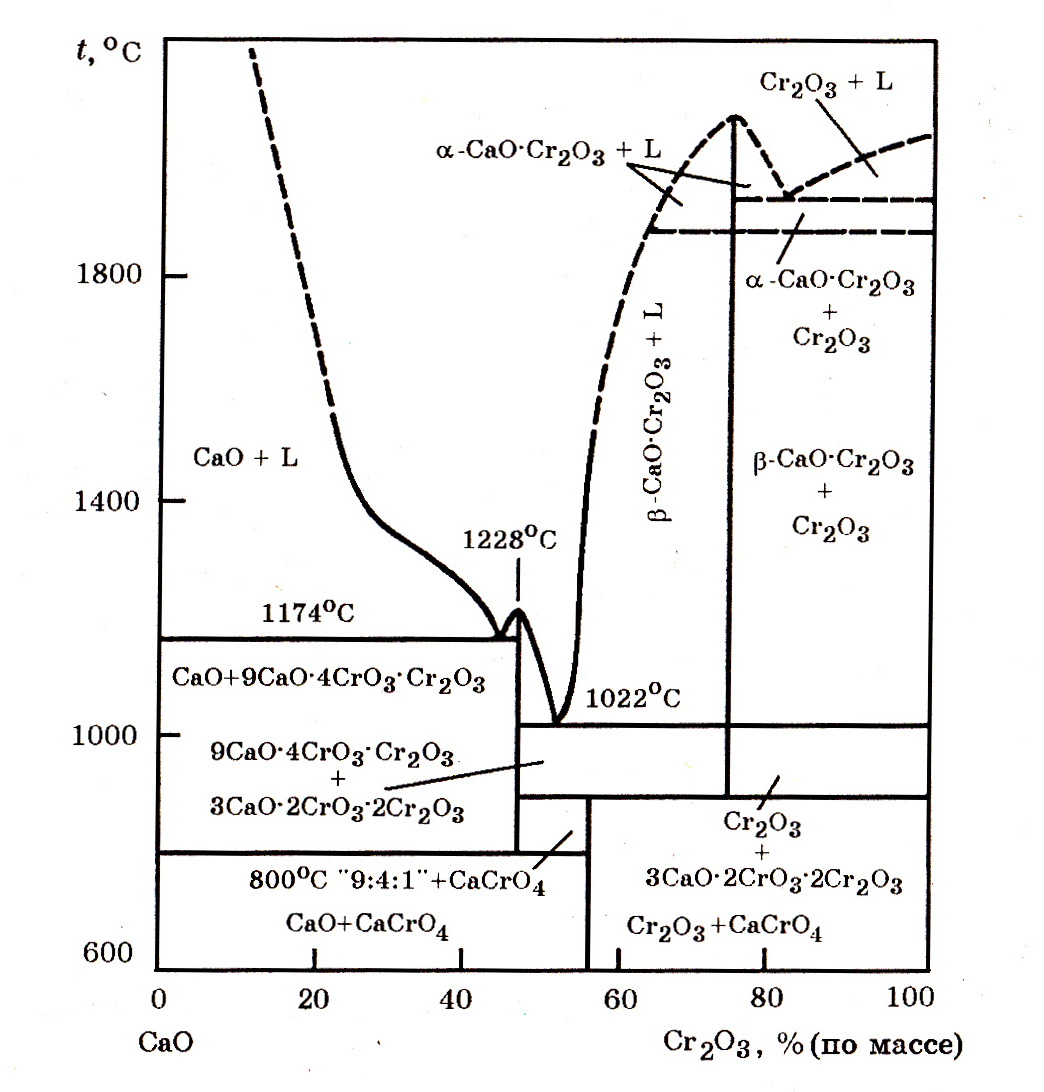
Рис. 7.9. Фазовые равновесии в псевдобинарной системе СаО–Cr2O3
Система CrO–SiO2(рис. 7.10). В системе образуется одно соединение – ортосиликат хрома 2CrO∙SiO2(Cr2SiO4), который разлагается по перитектической реакции. Оксид хрома («CrO») в чистом виде при низких температурах термодинамически неустойчив и на воздухе диспропорционирует по схеме: 3«СrО» → Cr2O3 + Сr. Кремнезем стабилизирует «СrО», образуя ортосиликат хрома. Теплота и изменениеэнтропии образования СrО из элементов составляют ∆Н![]() = –399,9 Дж/моль и S
= –399,9 Дж/моль и S![]() = 58,28 Дж/(моль∙K).
= 58,28 Дж/(моль∙K).