1.3 Термодинамика реакций образования карбидов |
Содержание > Глава 1. Физико-химические основы ферросплавных процессов > 1.3.Термодинамика реакций образования карбидов
Высоким химическим сродством большинства элементов к углероду обусловлено образование при восстановлении металлов из их оксидов углеродом не чистых металлов, а их карбидов. Термодинамический анализ реакций
(I) МеО + С = Ме + СО
(II) МеО + (1 + х) С = МеСх+ СО
подтверждает предпочтительность протекания реакции II вследствие образования карбида МеСх. Карбиды элементов образуются по экзотермическим реакциям
Ме + хС = МеСх + Q(–∆H),
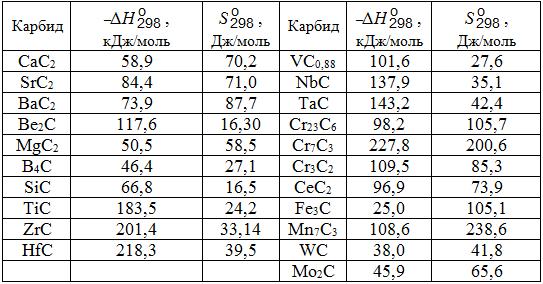
Таблица 1.1. Стандартные энтальпии образования и энтропии карбидов ферросплавных элементов

Щелочноземельные металлы (IIа-группа) образуют карбиды типа МеС2. И в этой группе металлов теплота образования карбидов повышается с увеличением номера элемента, т.е. в ряду МgС2 → СаС2 → BaС2.
Щелочные металлы (Iа-группа) образуют карбиды типа Ме2С2. Энтальпии образования Li2С2 равна –59,3кДж/моль, Nа2С2 –18,4 кДж/моль.
Более полную оценку термодинамической прочности карбидов дает анализ выражений изменения энергии Гиббса в зависимости от температуры. Так, функции ∆G![]() (T)для карбидов NbС и ТiС имеют вид (Дж/моль):
(T)для карбидов NbС и ТiС имеют вид (Дж/моль):
Nb2т+ C2т = NbC2т; ∆G![]() (NbC) = –130200 + 1,7Т,
(NbC) = –130200 + 1,7Т,
Тiт + Ст = ТiС2т; ∆G![]() (ТiС) = –185870 + 13,24Т.
(ТiС) = –185870 + 13,24Т.
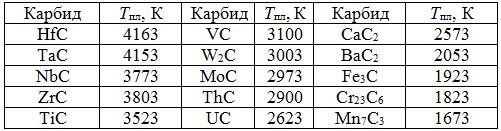
Таблица 1.2. Температуры плавления ферросплавных карбидов
Несмотря на относительно большую термодинамическую прочность карбидов в присутствии жидкого кремния они взаимодействуют по реакции
МехСу + zSi → MexSiz + yC