8.1. Свойства вольфрама и его соединений |
Содержание > ГЛАВА 8. Электрометаллургия вольфрама > 8.1. Свойства вольфрама и его соединений
Порядковый номер вольфрама в Периодической системе элементов Д.И.Менделеева 74, атомная масса 183,85, электронная конфигурация 4f145d46s2, ОЦК-структура (а = 0,3165 нм), плотность 19,3-19,9 г/см3, температура плавления 3410оС, температура кипения 5930оС.
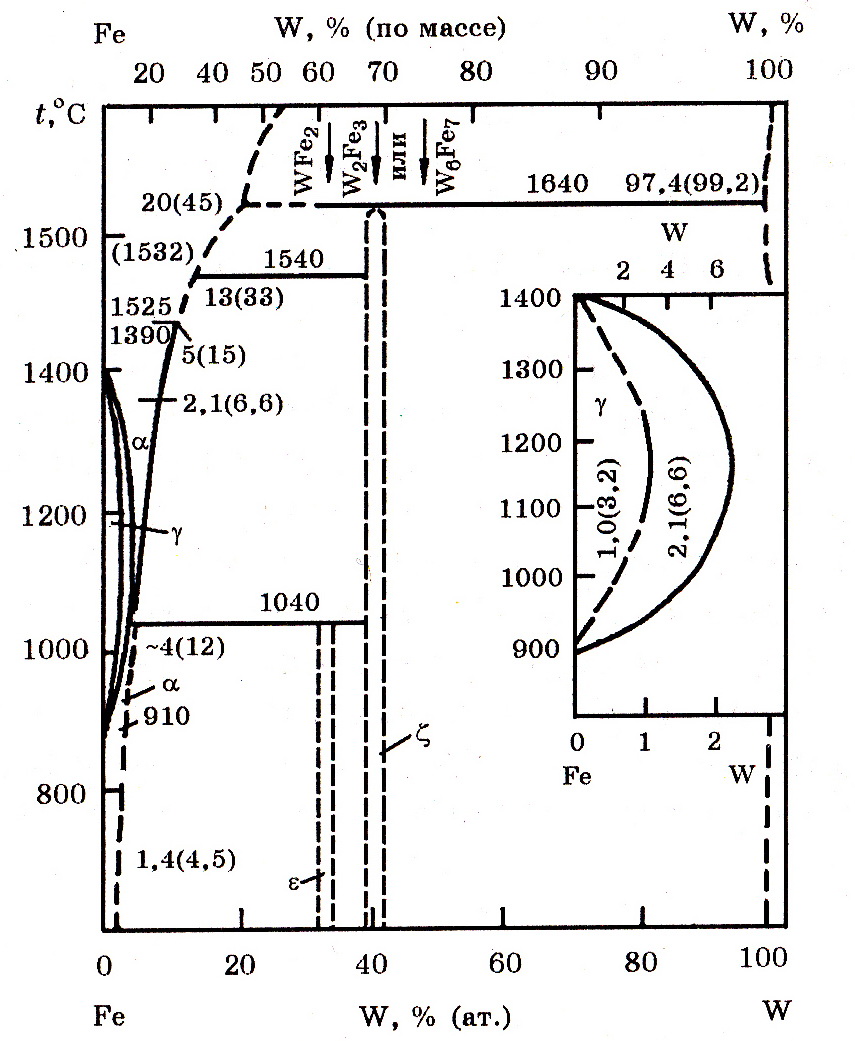
Система W–Fe (рис. 8.1). При стандартном содержании вольфрама в промышленном ферровольфраме 60%, температура расплава составляет около 2580оС.

Рис.8.1. Диаграмма равновесного состояния системы W-Fe
Система W–C (рис. 8.2).В системе W–C образуются карбиды W2C (3,07% С) и WC (6,12% С). Изменения стандартные энергии Гиббса образования карбидов вольфрама W2C и WC из элементов соответственно равны:
∆G![]() (W2C) = –49100 Дж/моль и
(W2C) = –49100 Дж/моль и
∆G![]() ( WC) = –37620 Дж/моль.
( WC) = –37620 Дж/моль.
Плотность W2C 17,5 г/см3, WC 15,5 г/см3, температура плавления равна 2795 и 2785оС соответственно.
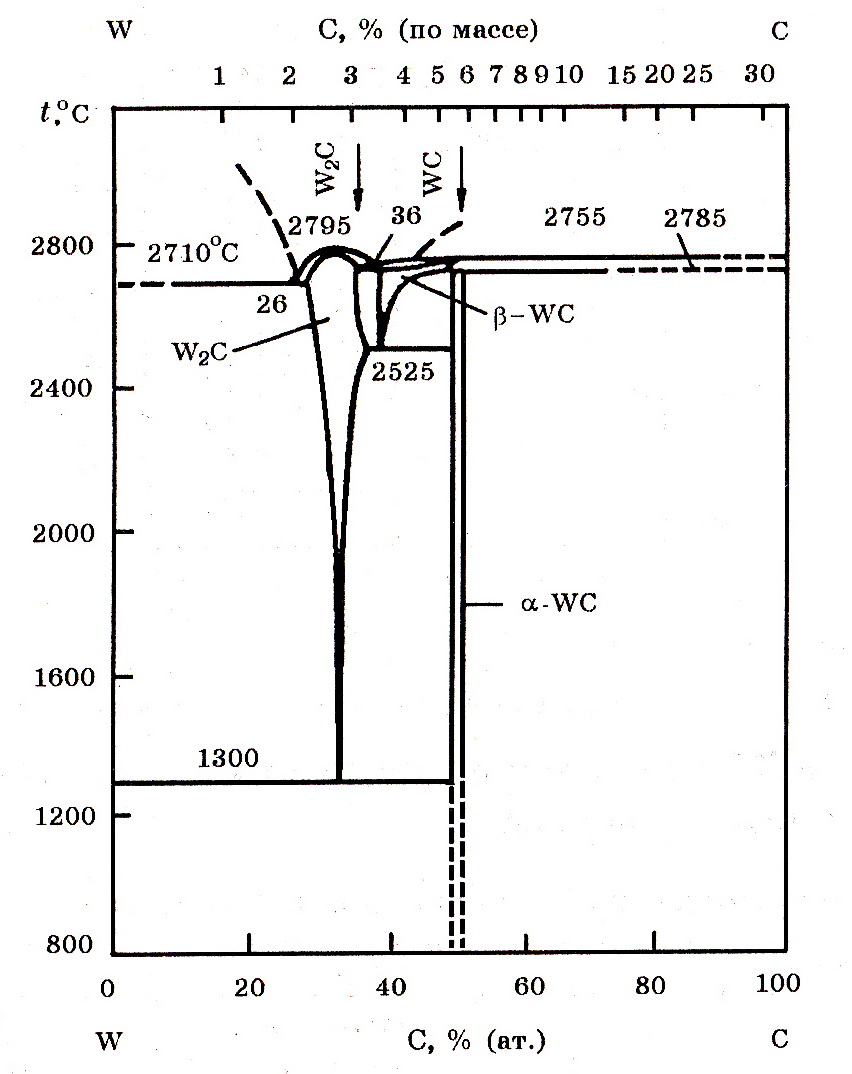
Рис. 8.2. Диаграмма равновесного состояния системы W–C
Система W–Si (рис. 8.3). В системе W–Si образуются силициды W3Si2 (9,21% Si) и WSi (23,3% Si) по реакциям:
3W + 2Si = W3Si2;
∆H![]() = -20950 Дж/моль;
= -20950 Дж/моль;
W + 2Si = WSi2;
∆H![]() = –93440 Дж/моль.
= –93440 Дж/моль.
Температура плавления W3Si2 равна 2310оС, WSi2 – 2065оС
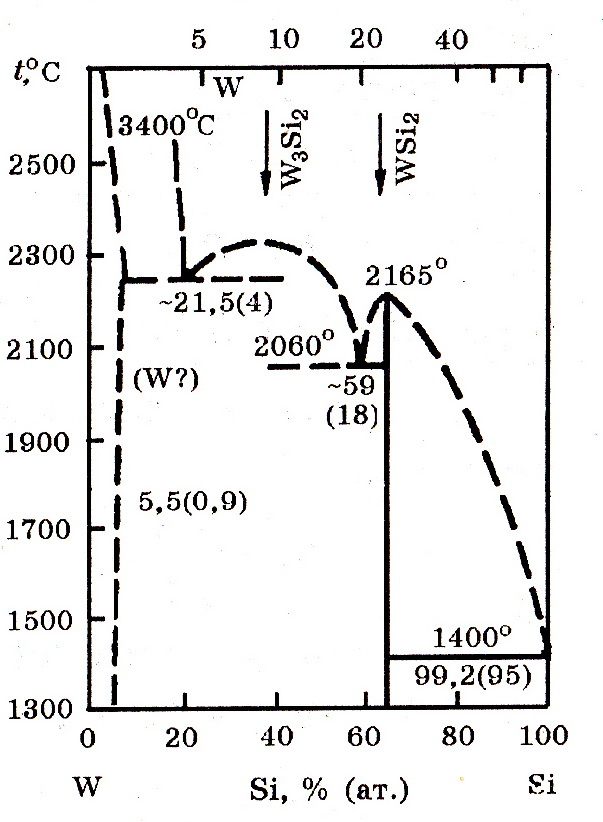
Рис.8.3. Диаграмма равновесного состояния системы W–Si
Система W–O (рис. 8.4). Вольфрам с кислородом образует ряд оксидов WO2, W4O11 и WO3.
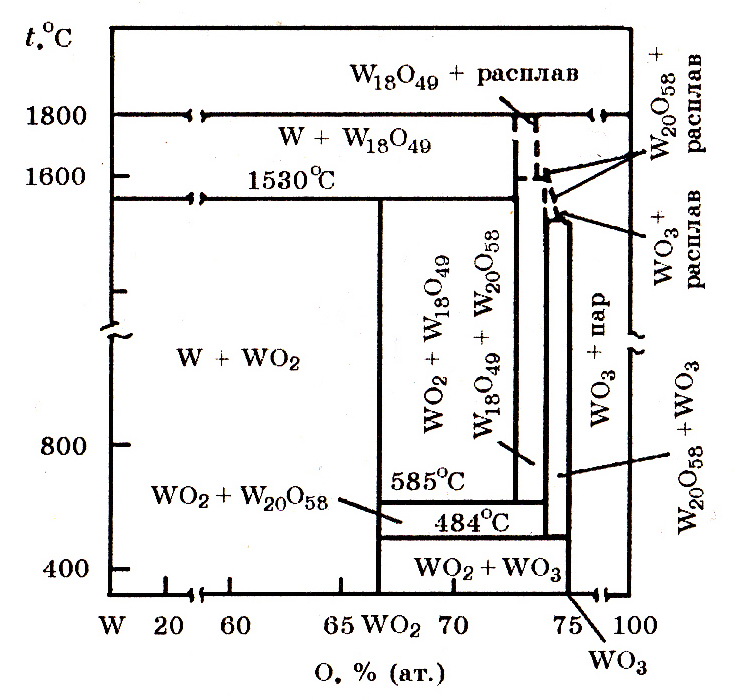
Рис. 8.4. Диаграмма равновесного состояния системы W–O
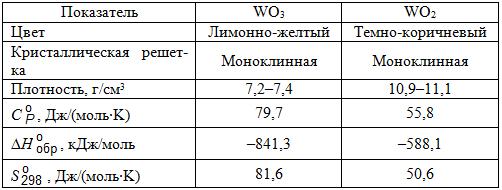
В табл. 8.1. приведены некоторые свойства кислородных соединений вольфрама.
Таблица 8.1. Некоторые свойства оксидов вольфрама
Для реакций образования оксидов зависимости ∆G![]() (Т) имеют вид:
(Т) имеют вид:
W(т) + 3/2О2 = WО3(т);
∆G![]() = –134333+42,63ТlgT + 383,3T, Дж/моль;
= –134333+42,63ТlgT + 383,3T, Дж/моль;
W(т) + О2 = WО2(т);
∆G![]() = –578930 +152,98Т, Дж/моль.
= –578930 +152,98Т, Дж/моль.