9.1. Свойства молибдена и его соединений |
Содержание > ГЛАВА 9. Силикоалюминотермия молиюдена > 9.1. Свойства молибдена и его соединений
Порядковый номер молибдена в Периодической системе Д.И.Менделеева 42, атомная масса 95,94; относится к 4d-переходным металлам, электронная конфигурация 4d55s1; имеет следующие физические и термодинамические константы: объемно-центрированную кристаллическую решетку ОЦК (а = 0,314 нм), температуру плавления 2622оС, кипения 4840оС, плотность 10,23 г/см3.
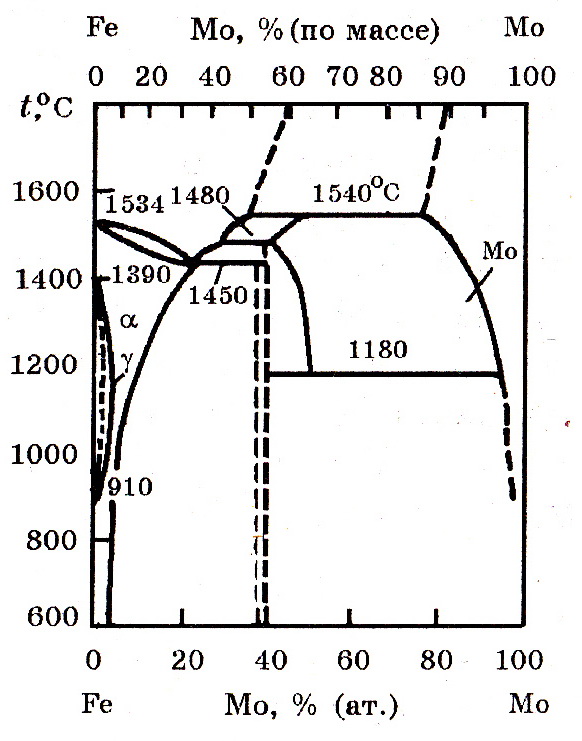
Система Мо–Fe (рис. 9.1). Железо и молибден образуют интерметаллиды FeMo, Fe7Mo6 и твердые растворы.

Рис. 9.1. Диаграмма равновесного состояния системы Mo–Fe
Температура плавления (ликвидус) сплавов при повышении массового содержания молибдена до 37,5% несколько снижается, дальнейшее увеличение содержания молибдена приводит к ее значительному росту. Бинарный сплав с 55–58% Мо плавится при температуре, превышающей 1650оС.
Максимальная растворимость железа в твердом молибдене при 1610оС составляет 25% (ат.).
Система Мо–С (рис. 9.2). Молибден с углеродом образуют карбиды Мо2С (5,88% С) и МоС1-х. Карбид Мо2С плавится без разложения при 2480оС. Термодинамические характеристики Мо2С следующие: ∆Н![]() = –10660 Дж/моль; S
= –10660 Дж/моль; S![]() = 65,90 Дж/(моль∙K). Зависимость изменения энергии Гиббса от температуры реакции образования Мо2С описывается выражением:
= 65,90 Дж/(моль∙K). Зависимость изменения энергии Гиббса от температуры реакции образования Мо2С описывается выражением:
2Мо(т) + С(т) = Мо2С(т); ∆G![]() = –47530 – 9,46T, Дж/моль.
= –47530 – 9,46T, Дж/моль.
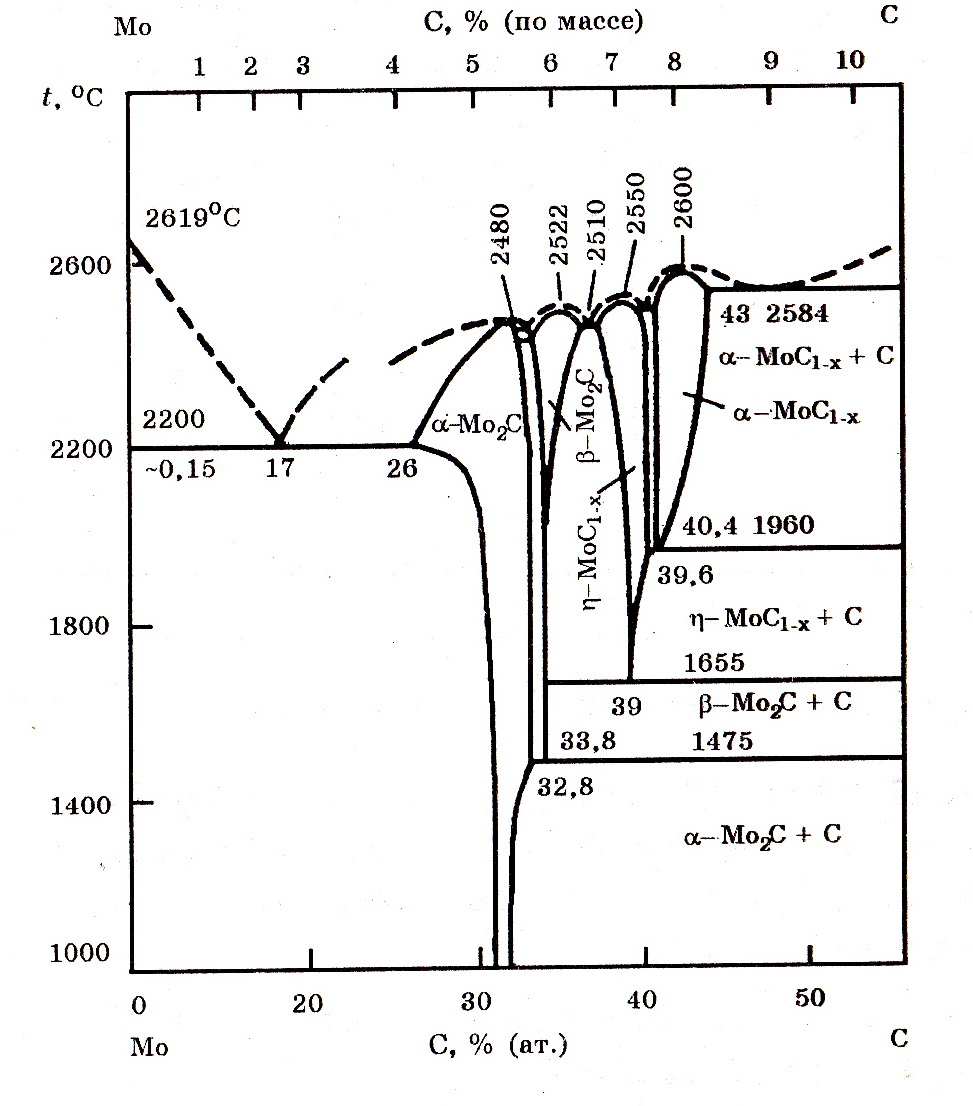
Рис. 9.2. Диаграмма равновесного состояния системы Мо–С
Углерод в небольших количествах растворяется в твердом молибдене с образованием твердого раствора углерода на основе молибдена.
В тернарной системе Mo–Fe–C установлено образование карбидов (Fe, Mo)3C и (Fe, Mo)23C6; (Fe, Mo)6C; (Mo, Fe)2C.
Система Мо–Si(рис. 9.3). В этой системе известны силициды Мо3Si (8,86% Si), Mo5Si3 (14,89% Si) и MoSi2 (36,84% Si). Энтальпия реакций образования силицидов из элементов характеризуется следующими данными:
3Мо(т) + Si(т) = Mo3Si(т); ∆Н![]() = –116,2 кДж/моль;
= –116,2 кДж/моль;
5Мо(т) + 3Si(т) = Mo5Si3(т); ∆Н![]() = –309,7 кДж/моль;
= –309,7 кДж/моль;
Мо(т) + 2Si(г) = MoSi2; ∆Н![]() = –183,5 кДж/моль.
= –183,5 кДж/моль.
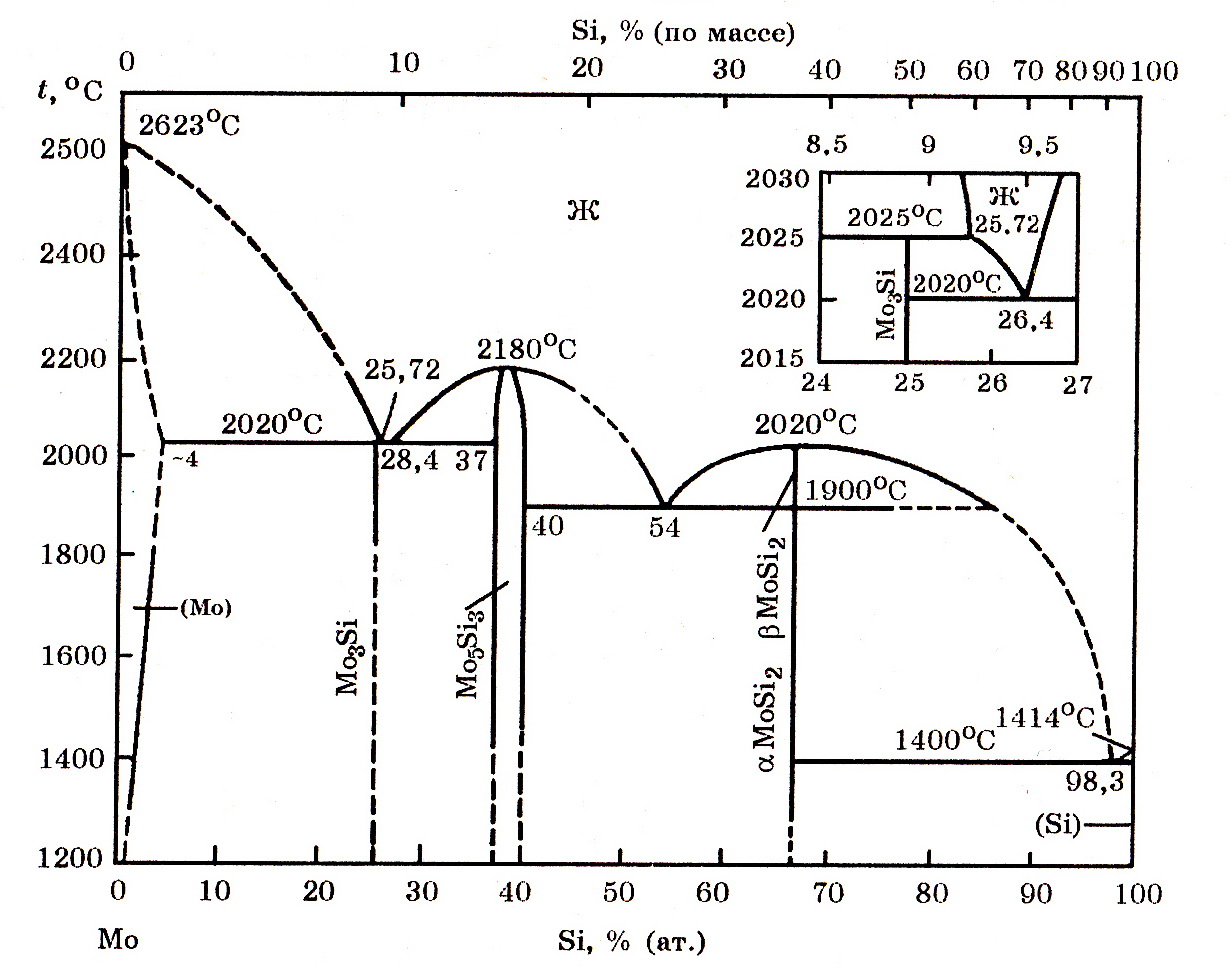
Рис. 9.3. Диаграмма равновесного состояния системы Мо–Si
Силицид MoSi2 существует в α- и β-модификациях, температура превращения α-МоSi2 ↔ β-MoSi2 равна 1900оС. Максимальная растворимость кремния в Мо достигает 3,52% (ат.) при 2053оС.
Система Mo–Al. Известны алюминиды МоAl12, MoAl6, MoAl5, MoAl4, Mo3Al8, Mo3Al.
Система Мо–Р. В системе образуются фосфиды Мо3Р (9,72% Р), МоР2 (39,23% Р). Фосфид МоР образует с молибденом эвтектику при 12% Р (tэв = 1650оС).
Система Мо–S(рис. 9.4). Известны сульфиды молибдена Mo2S3, MoS2 и MoS3. Для реакции Мо(т) + S2(г) = MoS2(т) изменение энергии Гиббса имеет вид ∆G![]() = –368258 + 155,91Т, Дж/моль.
= –368258 + 155,91Т, Дж/моль.
Сульфид Mo2S3 неустойчив ниже 605оС и при нагревании (при нормальном давлении) он диссоциирует. Для реакции 4/3Мо + S2 = 2/3Mo2S3 функция ∆G![]() (Т) = –358226 + 152,19Т, Дж/моль.
(Т) = –358226 + 152,19Т, Дж/моль.
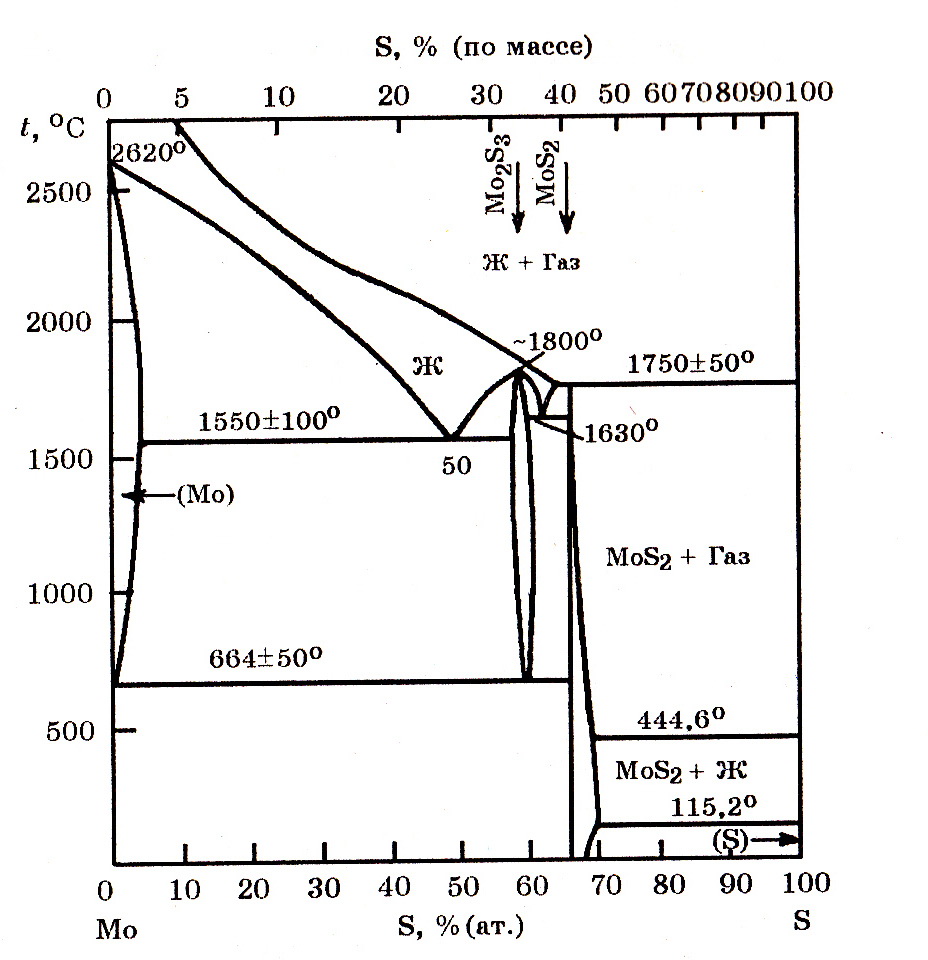
Рис. 9.4. Диаграмма равновесного состояния системы Мо–S
Система Мо–О (рис. 9.5). Кислород в твердом молибдене растворяется в незначительных количествах. С кислородом молибден образует оксиды: МоО3, МоО2, а также Мо3О; Мо17О47; МоО2,80; Мо8О23.
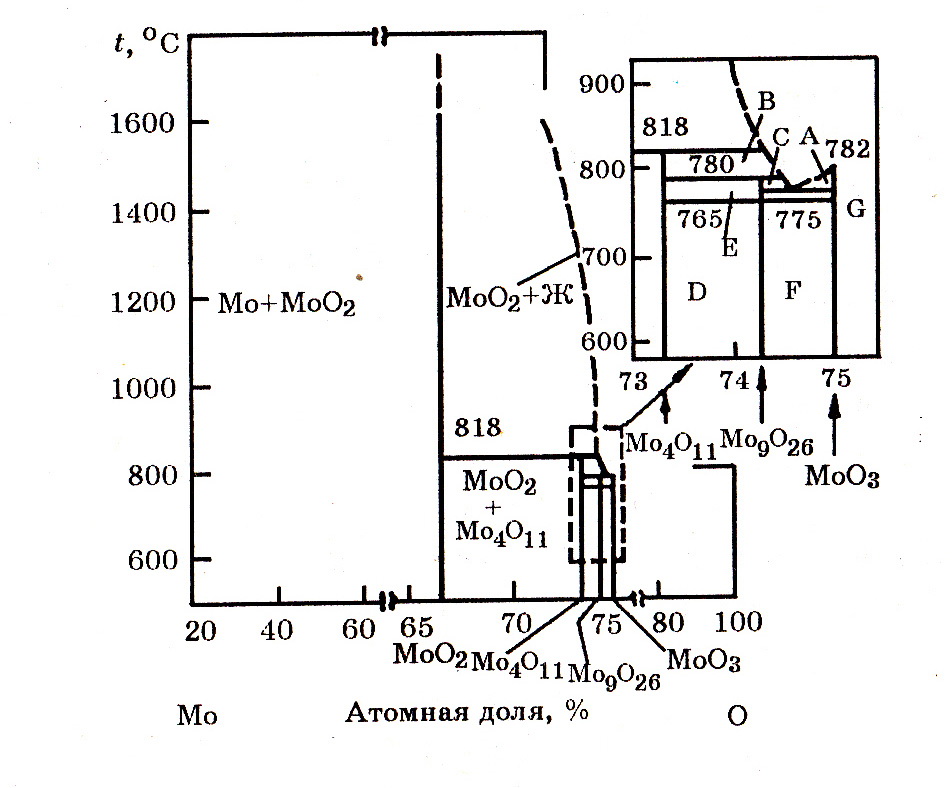
Рис. 9.5. Диаграмма равновесного состояния системы Мо–О:
А – МоО3 + Ж; В – Мо4О11 + Ж; С – Мо9О26 + Ж; D – Мо4О11 + Мо9О23;
E – Мо4О11(β) + Мо9О26; F – Мо9О26(γ) + МоО3; G – Мо9О26(β) + МоО3
Термодинамические константы оксидов молибдена следующие:
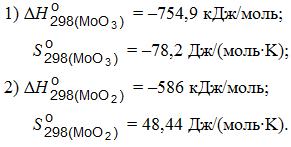
Изменение энергии Гиббса для реакций образования оксидов молибдена с температурой может быть рассчитано по уравнениям:
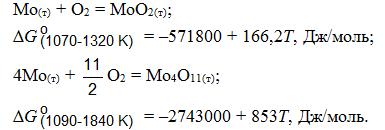
Газообразный МоО3, образующийся при 520-720оС, состоит из пара смеси молекул различного состава над МоО3, давление которого при различных температурах следующее:
![]()
Испарение МоО увеличивается в присутствии водяного пара. При 690оС и давлении водяного пара 798 кПа давление пара МоО3 возрастает примерно в 4 раза, поскольку образуются сложные молекулы МоО3∙Н2О. С этими свойствами МоО3 связано повышенное испарение и возможные потери оксидов молибдена при обжиге молибденитового (МоО2) концентрата.
Особенностями оксида МоО3 являются низкая температура плавления (1068 K) и высокое давление пара над ним. Относительный состав пара МоО3(т) для различных температур характеризуется следующими данными, %:
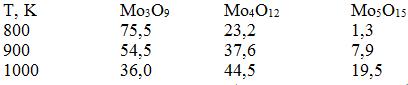
Температурная зависимость общего давления пара (МПа) над МоО3(т) имеет вид: lgPобщ = –1545/Т + 0,526.