∆G
9.3. Окислительный обжиг молибденитового концентрата |
Содержание > ГЛАВА 9. Силикоалюминотермия молиюдена > 9.3. Окислительный обжиг молибденитового концентрата
В отличии от руд и концентратов, используемых в производстве большинства ферросплавов, молибденитовые концентраты содержат до 35% S, представленной в основном молибденитом МоS2, сульфидами меди, железа и других элементов. Поэтому концентрат подвергают окислительному обжигу для перевода сульфида молибдена в кислородные соединения МоО2 и МоО3. Окисление серы сульфидных минералов происходит кислородом воздуха с образованием МоО2 по реакции
МоS2 + 7/2O2 = MoO3 + 2SO2;
∆G![]() = –1123670 – 340,2TlgT + 351,3T, Дж/моль
= –1123670 – 340,2TlgT + 351,3T, Дж/моль
с последующим взаимодействием МоО3 с сульфидами молибдена
МоS2 + 6MoO3 = 7MoO2 + 2SO2;
∆G![]() = 185580 + 204,3TlgT – 915,5T, Дж/моль.
= 185580 + 204,3TlgT – 915,5T, Дж/моль.
Реакция окисления MoS2 до MoO3 экзотермична и сопровождается выделением большого количества тепла, поэтому внешний обогрев необходим только в конце процесса обжига, когда количество сульфида молибдена в продукте обжига становится невелико. Одновременно с этим протекают также процессы окисления сульфидов других металлов (FeS2, Cu2S, ZnS, NiS и др.), присутствующих в качестве примесей в товарных молибденовых концентратах.
Обжиг ведут в окислительной атмосфере в вертикальных восьмиподовых печах (рис. 9.6) диаметром 6,8 м при максимальной температуре 680–750оС. Более высокие температуры могут привести к большим потерям молибдена в результате испарения МоО3. Остаточное содержание серы в концентрате не должно превышать 0,05–0,15%.
Производительность одной обжиговой печи составляет 950 кг/ч обожженного концентрата. Согласно ТУ14-5-88-77 концентрат молибденовый обожженный (КМО) должен иметь химический состав, приведенный в табл. 9.2.
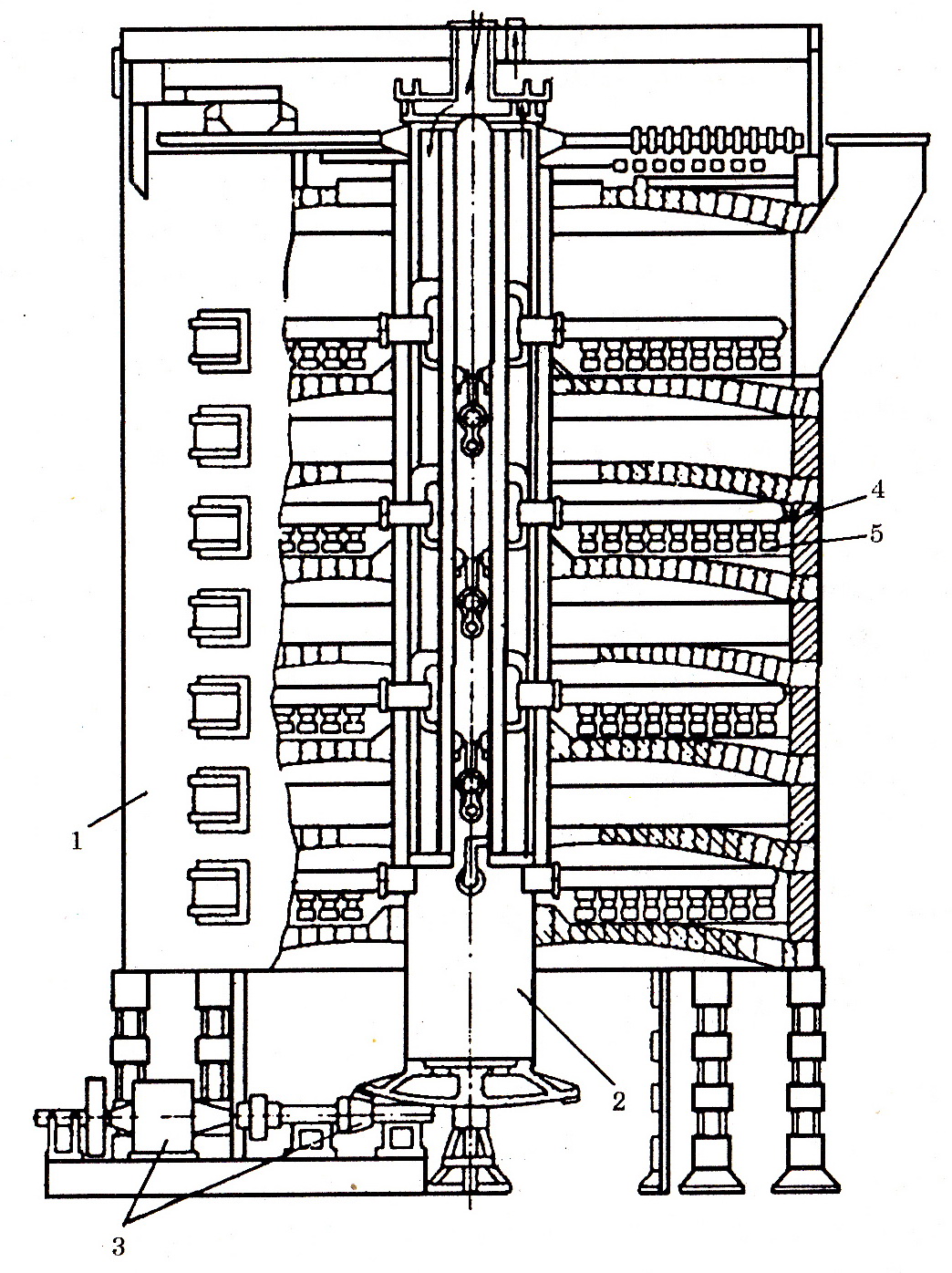
Рис. 9.6. Вертикальная многоподовая печь для обжига молибденита (ЧЭМК): 1 – кожух печи; 2 – вертикальный вращающийся вал; 3 – коническая пара; 4 – гребни; 5 – лопатки
Таблица 9.2. Химический состав, %, обожженного молибденового концентрата
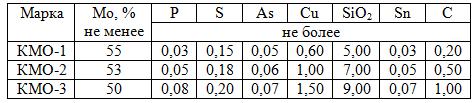
Кроме указанных в табл. 9.2 элементов концентрат содержит: 14–16% СаО, 0,5–3,2% FeO, 1,2–1,4% MgO, 0,6–0,8% Al2O3, 0,10–0,25% P, 0,5–0,15% W, а также небольшое (<0,005% каждого) количество цветных металлов (Sb, Bi, Zn, Cd). Часть молибдена (<10%) в обожженном концентрате представлена МоО2, а остальное – МоО3.
Термодинамическое моделирование процесса обжига молибденового концентрата. Несмотря на кажущуюся простоту технологии окислительного обжига молибденового концентрата, реальный промышленный процесс получения молибденового окисленного концентрата, пригодного для выплавки стандартного ферромолибдена, представляет собой сложную металлургическую систему. Качество и выход концентрата зависит от ряда определяющих факторов: минералогического и гранулометрического составов исходного концентрата, температурного режима обжига, окислительного потенциала печной газовой фазы, продолжительности обжига и др. Выявление рационального сочетания факторов, влияющих на процесс обжига и качество окисленного молибденового концентрата, представляет одну из сложных экспериментальных задач.
Достоверность данных научно обоснованных поисков параметров окислительного обжига повышается, а продолжительность оптимизации сокращается при термодинамическом моделировании процесса.
Выполнено термодинамическое моделирование равновесных состояний в системе Мо–Si–Fe–Mg–Al–Cu–O–S*. Температура процесса изменялась в интервале от 50 до 1250оС при общем давлении газовой фазы 101,3 кПа. Причем процесс исследовали в атмосфере аргона и атмосфере кислорода с различным объемом контактирующего газа. В расчетах учитывали термохимические и термодинамические характеристики 60 элементов и соединений (оксидов, сульфидов) в газообразном состоянии, а также 67 конденсированных фаз (оксидов, сульфидов, металлоидов и др.).
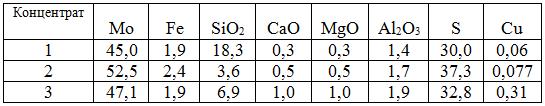
Термодинамическое моделирование проведено применительно к использованию трех молибденовых концентратов, химические составы которых приведены в табл. 9.4.
В атмосфере аргона процесс термической диссоциации MoS2 и других соединений всех трех видов концентратов не происходит. В атмосфере кислорода при стехиометрической потребности кислорода оксид МоО3 у всех видов кон-центратов появляется уже при 20оС и остается до 770оС, а свыше этой температуры оксид МоО3 испаряется. Образование при 950оС стабильного СаМоО4 снижает улет МоО3. В интервале 950–1050оС образуется FeO×SiO2. При более высоких температурах термодинамически предпочтительно наряду с СаМоО4 образование муллита 3Al2O3∙SiO2.
Таблица 9.4. Химические составы, %, молибденовых концентратов
Анализ результатов термодинамического моделирования показывает, что в случае обжига всех трех концентратов в атмосфере кислорода (до 1250оС) в количестве стехиометрически необходимом для окисления MoS2 и других сульфидов в продуктах окисления образуется один оксид молибдена МоО2. При обжиге в атмосфере кислорода с недостатком в 22% от стехиометрически необходимого наряду с МоО3 сосуществует и МоО2. Причем, при 820оС и выше содержание МоО3 снижается до полного исчезновения при 1020оС, а продуктом окисления является МоО2.
Таким образом, на примере результатов термодинамического моделирования процесса окислительного обжига молибденитовых концентратов трех сортов получены общие закономерности реакционных превращений минералов: образование МоО3 и улет его свыше 770оС, образование СаМоО4 свыше 950оС, экзотермичность процесса в интервале 100–600оС. Вместе с тем, различие химических и минералогических составав концентратов обусловливает и разное содержание минеральных фаз в обожженном концентрате.