Ti(т) + C(т) = TiC(т); ∆G
Эвтектика со стороны титанового угла диаграммы имеет температуру tэв = 1645оС, а со стороны угла углерода – tэв ≈ 2900оС.
11.1. Свойства титана и его соединений |
Содержание > ГЛАВА 11. Электрометаллургия ферротитана > 11.1. Свойства титана и его соединений
Титан имеет атомный номер 22, относится к переходным металлам первого большого периода системы элементов Д.И.Менделеева. Атомная масса титана 47,88, электронная конфигурация атома 3d24s2, температуры плавления 1671оС, кипения 3260оС, плотность 4,5 г/см3, проявляет валентность 2, 3 и 4. Титан существует в двух аллотропических модификациях: α-Ti с гексагональной плотноупакованной решеткой, а = 0,2951 нм, с = 0,4697 нм и β-Ti с кубической объемноцентрированной решеткой, а = 0,3269 нм. Температура превращения α-Ti ↔ β-Ti равна 883оС.
Система Ti–Fe(рис. 11.1). В жидком состоянии титан и железо образуют раствор с неограниченной растворимостью. В твердом состоянии образуют соединения TiFe2 и TiFe. Как следует из данных рис. 11.1, соединение TiFe2 плавится конгруэнтно при 1530оС, а TiFe - инконгруэнтно при 1317оС. В системе имеются две эвтектики: одна со стороны железного угла диаграммы (tэв = 1340оС; 14% Ti), вторая – со стороны титанового угла диаграммы (tэв = 1085оС; 71% Ti). Титан относится к группе ферритообразующих элементов и поэтому существенно сужает g-область (область аустенитной структуры).
Система Ti–C (рис. 11.2). С углеродом титан образует термодинамически прочный карбид TiC (tпл = 3357оС, плотность 4,4 г/см3) по реакции:
Ti(т) + C(т) = TiC(т); ∆G![]() = –186870 + 13,24Т, Дж/кал.
= –186870 + 13,24Т, Дж/кал.
Эвтектика со стороны титанового угла диаграммы имеет температуру tэв = 1645оС, а со стороны угла углерода – tэв ≈ 2900оС.
Система Ti–Si (рис. 11.3). Известны силициды Ti5Si3, TiSi, TiSi2. Силициды Ti5Si3 и TiSi2 плавятся конгруентно при температурах 2120 и 1540оС соответственно, моносилицид TiSi – инконгруентно при 1760оС. В системе имеются три эвтектики с температурами плавления 1330, 1490 и 1330оС.
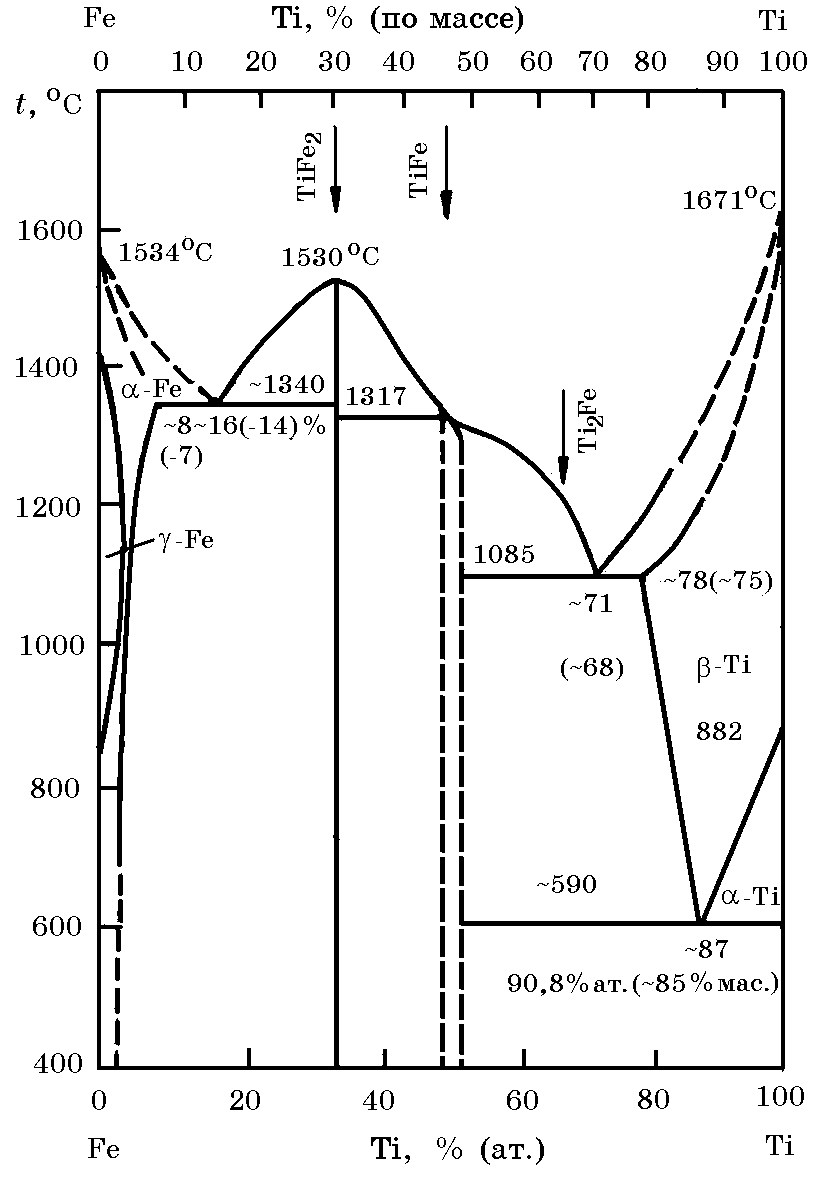
Рис. 11.1. Диаграмма равновесного состояния системы Ti–Fe
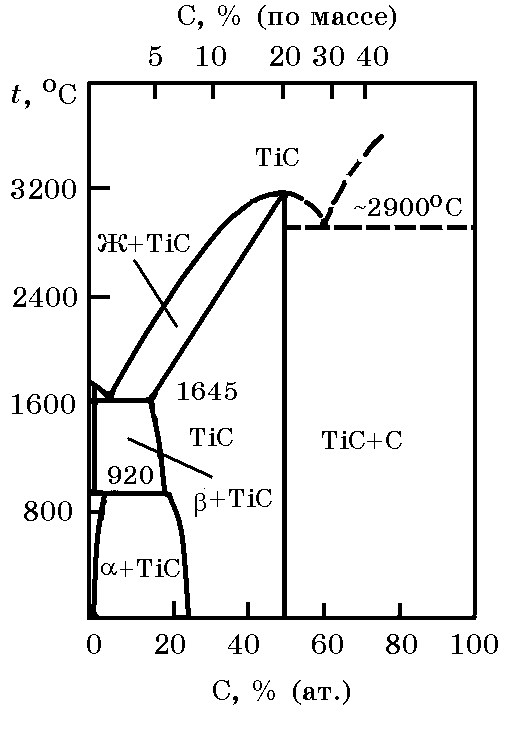
Рис. 11.2. Диаграмма равновесного состояния
системы Ti–C
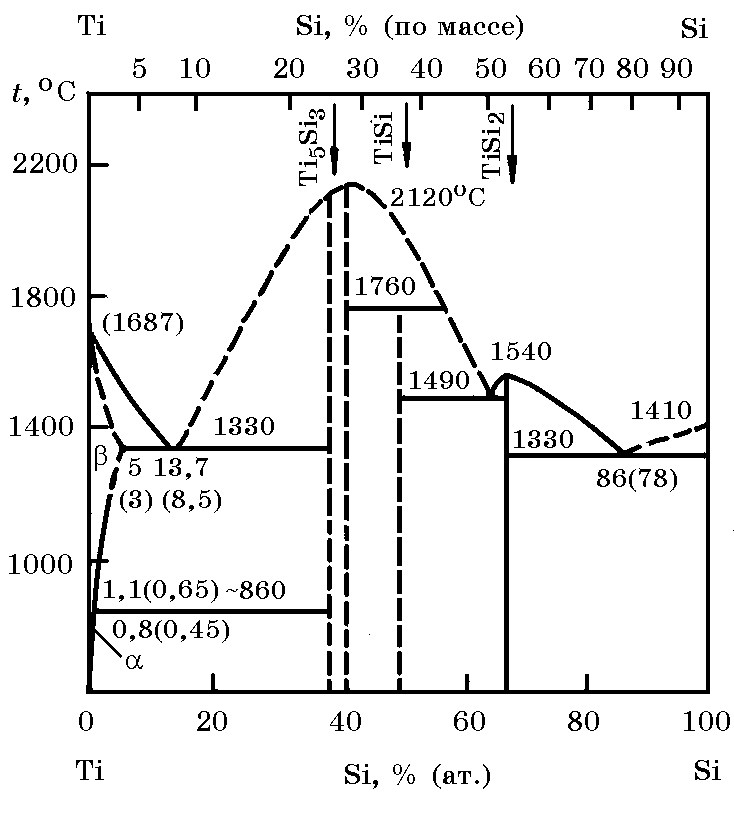
Рис. 11.3. Диаграмма равновесного состояния системы Ti–Si
Силициды титана образуются по реакциям:
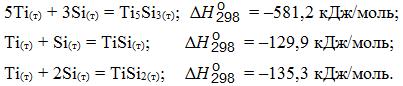
Все силициды имеют высокую термодинамическую прочность.
Система Ti–Al (рис. 11.4). Титан с алюминием образует твердые растворы и ряд соединений – алюминидов Ti3Al, TiAl, TiAl2 и TiAl3. Алюминиды Ti3Al, TiAl имеют широкую область гомогенности.
В системе Ti–O (рис. 11.5) образуются следующие оксиды: TiO2 (tпл = 1855оC); Ti3O5 (tпл = 2177оC); Ti2O3 (tпл = 2137оC); TiO (tпл = 1737оC). В интервале составов Ti2O3-TiO2 известен ряд промежуточных оксидов Ti2O5, Ti4O7 и др.
Образование оксидов титана (1500-1940 K) происходит по реакциям (в Дж/моль):
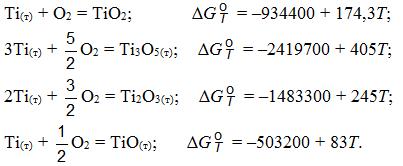
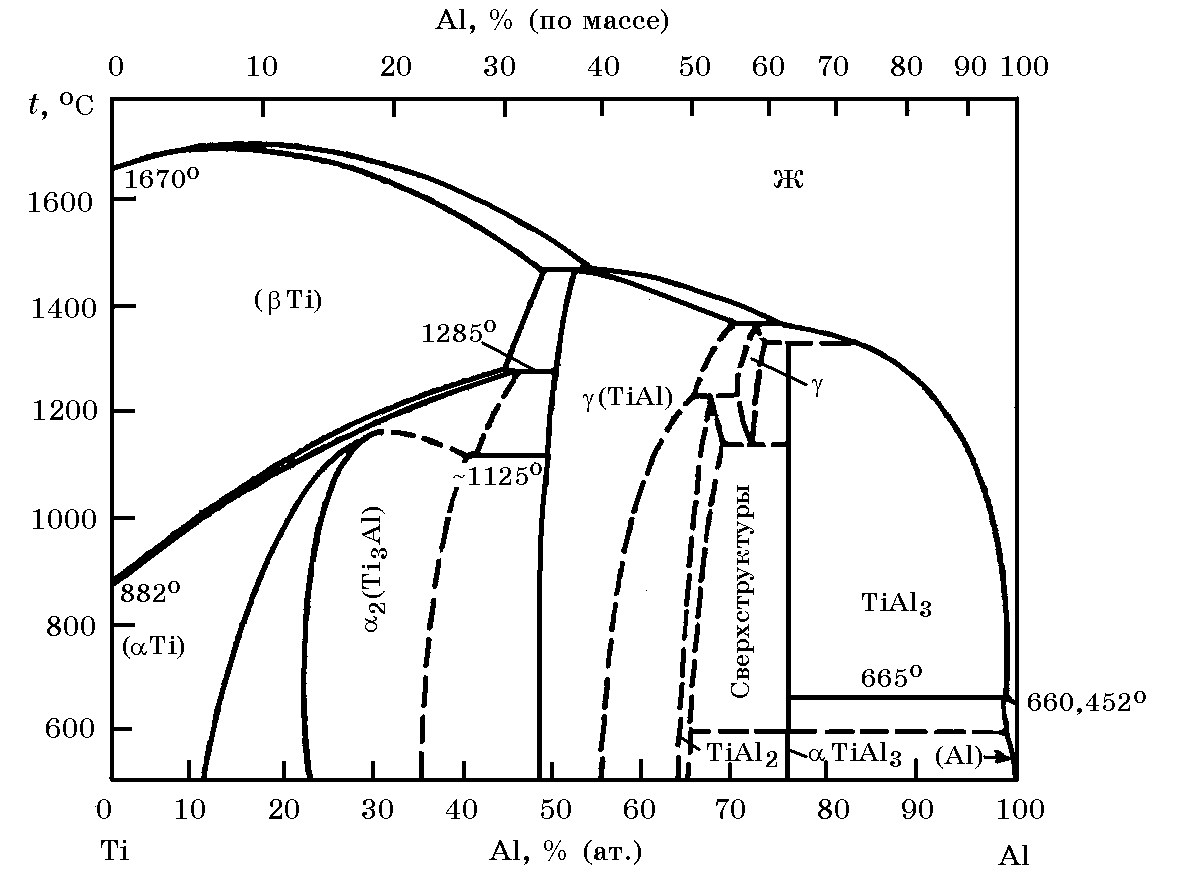
Рис. 11.4. Диаграмма равновесного состояния системы Ti-Al
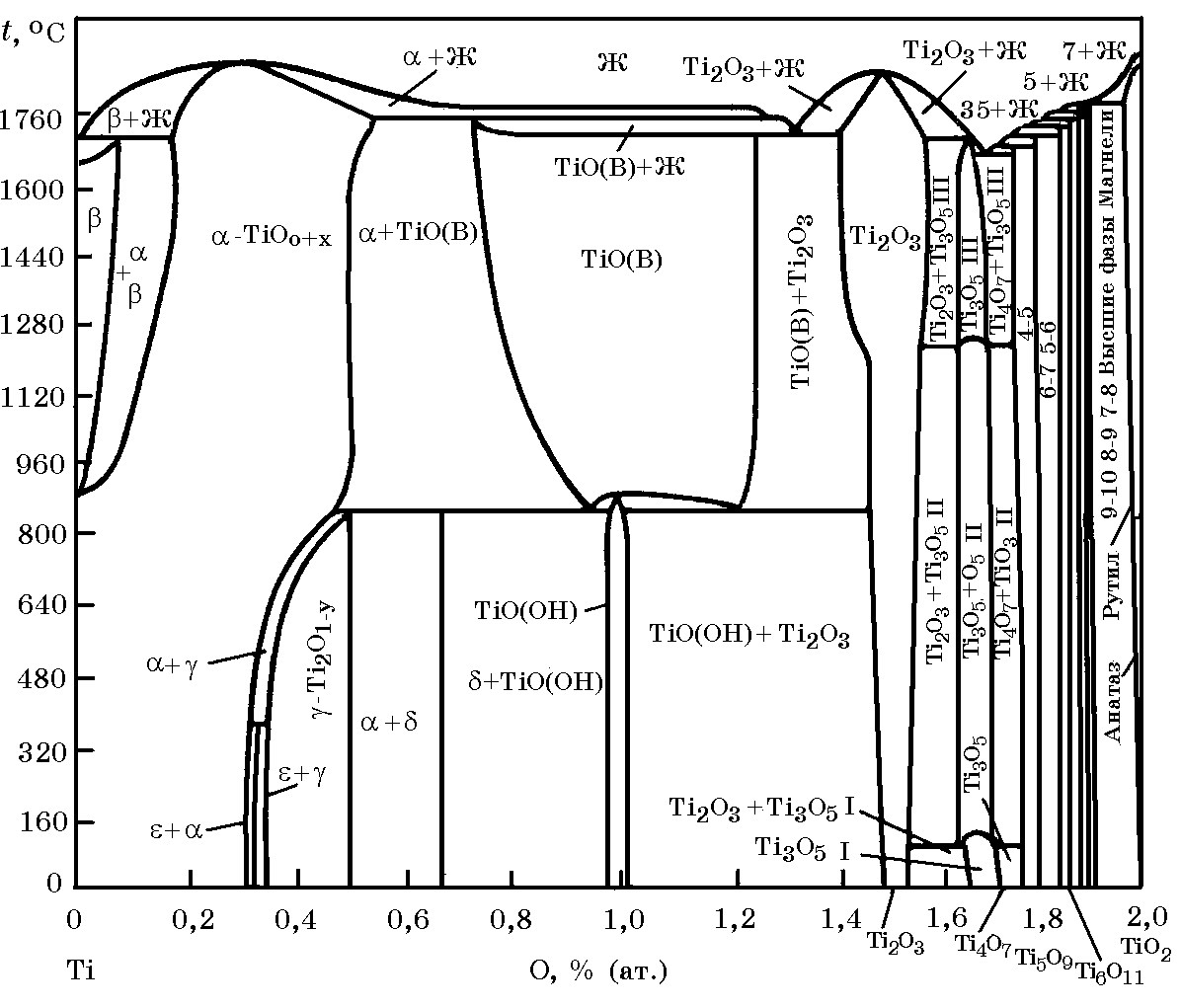
Рис. 11.5. Диаграмма состояния системы Ti–O, построенная по обобщенным данным (α–TiOx – твердый раствор кислорода в титане; х – атомная доля кислорода; у – атомная доля кислорода; e - твердый раствор кислорода в титане); высоко- и низкотемпературные модификации монооксида титана Ti3O5; I, II, III – фазы магнели; 4 – Ti4O7;
5 – Ti5O9; 6 – Ti6O11; 7 – Ti7O13; 8 – Ti3O15
Система FeO–TiO2 (рис. 11.6).Для оптимизации технологических параметров получения ферротитана важное значение имеют данные о диаграммах состояния бинарных и сложных оксидных систем. В системе FeO–TiO2 имеются соединения 2FeO∙TiO2; FeO∙TiO2 и FeO∙2TiO2 и четыре эвтектики, температуры плавления которых указаны на рис.11.6. Оксид TiO2 обладает кислотными свойствами, поэтому с основным оксидом СаО легко образует соответствующие соединения, составы которых до сих пор уточняются (рис. 11.7).
Рис. 11.6. Диаграмма равновесного состояния системы FeO–TiO2
Зависимость изменения энергии Гиббса реакции образования некоторых промежуточных соединений в системе СаО-TiO2 в зависимости от температуры имеют следующий вид (Дж/моль):
∆G![]() (СаО∙TiO2) = –71360 – 11,14Т (1527-1728 К).
(СаО∙TiO2) = –71360 – 11,14Т (1527-1728 К).
В системе TiO2–Al2O3 (рис.11.8) обнаружено единственное соединение TiO2∙Al2O3. Два кислотных оксида TiO2 и SiO2 не образуют соединений, имеется эвтектика при 10% TiO2 (tэвт = 1540оС) (рис. 11.9).
В системе СаО–SiO2–TiO2 (рис. 11.10) имеются соединения и эвтектики. Поля устойчивости отдельных минеральных фаз очерчены жирными линиями, выделены концентрационные поля сфена*, перовскита, рутила и кремнезема.
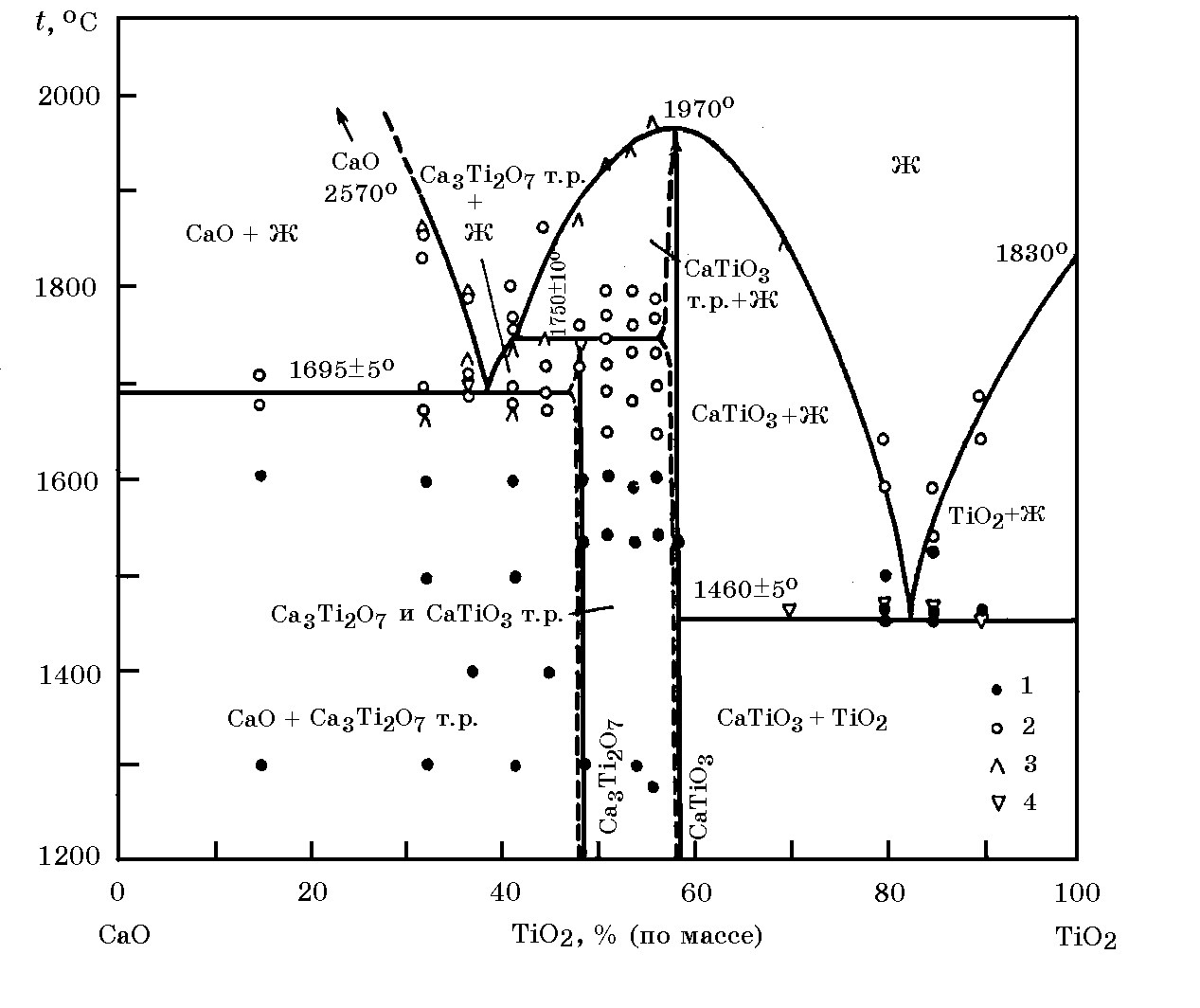
Рис. 11.7. Диаграмма равновесного состояния системы CaO–TiO2 (по Де Вризу с сотр.): 1 – результаты, полученные методом закалки; 2 - результаты, полученные в каскадной печи; 3 – результаты, полученные на обжигавшихся образцах; 4 – результаты термического анализа
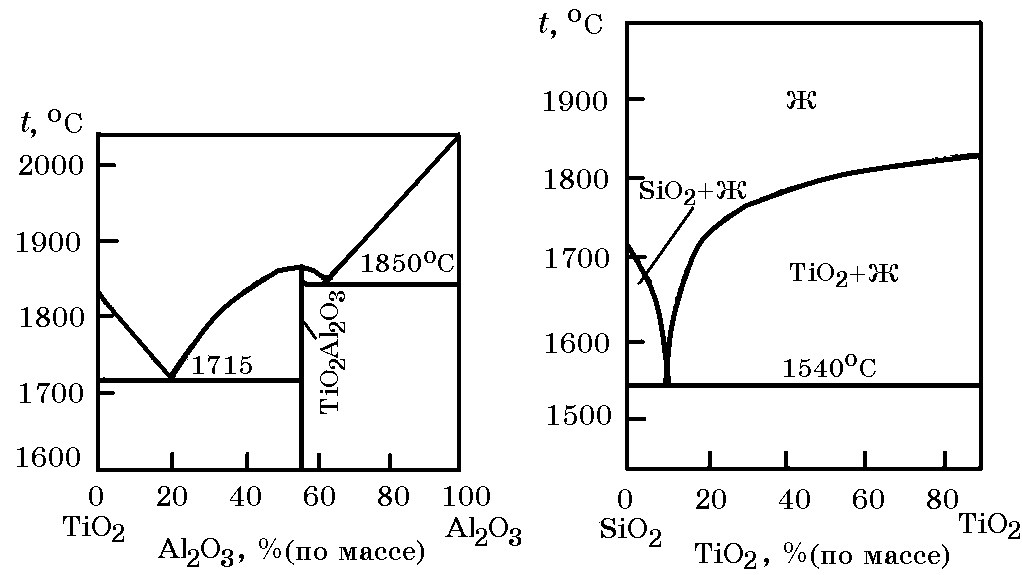
Рис. 11.8. Диаграмма равновесного состояния системы Al2O3–TiO2
Рис. 11.9. Диаграмма равновесного состояния системы SiO2–TiO2
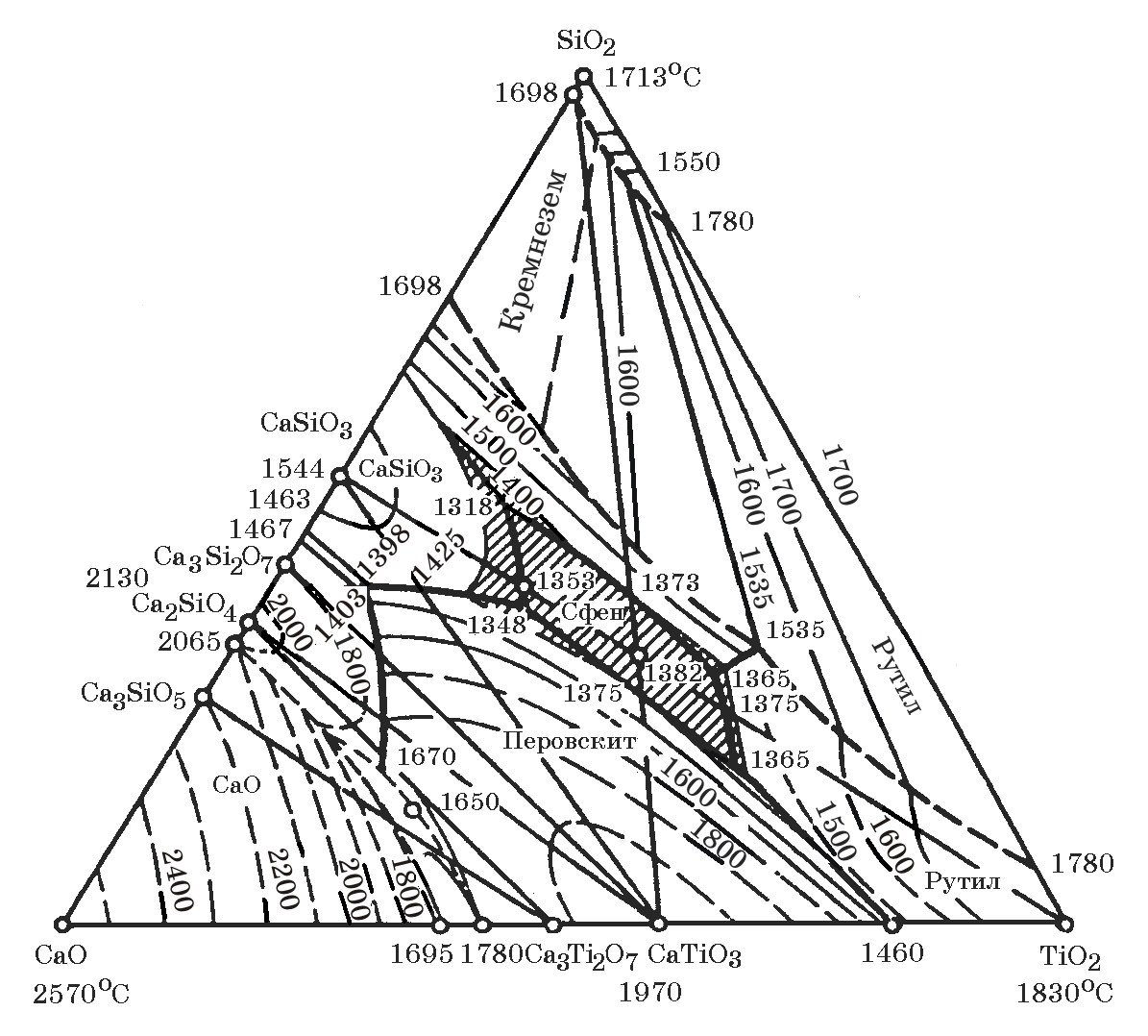
Рис.11.10. Диаграмма равновесного состояния системы CaO–TiO2–SiO2