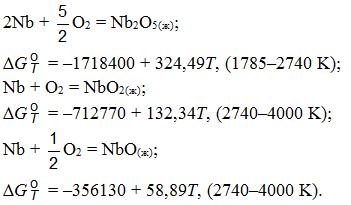12.1. Свойства ниобия и его соединений |
Содержание > ГЛАВА 12. Электрометаллургия феррованадия > 12.1. Свойства ниобия и его соединений
Ниобий относится к элементам V группы Периодической системы элементов Д.И.Менделеева. Порядковый номер 41, атомная масса 92,90, электронная конфигурация атома 4d45s1 температура плавления 2470оС, температура кипения 4927оС, энтропия 36,5 Дж/(моль∙K), плотность 8,57 г/см3. Кристаллическая решетка объемно-центрированная кубическая с параметром а = 0,3294 нм. Наиболее устойчивы соединения пятивалентного ниобия, но известны соединения со степенями окисления 4, 3, 2 и 1.
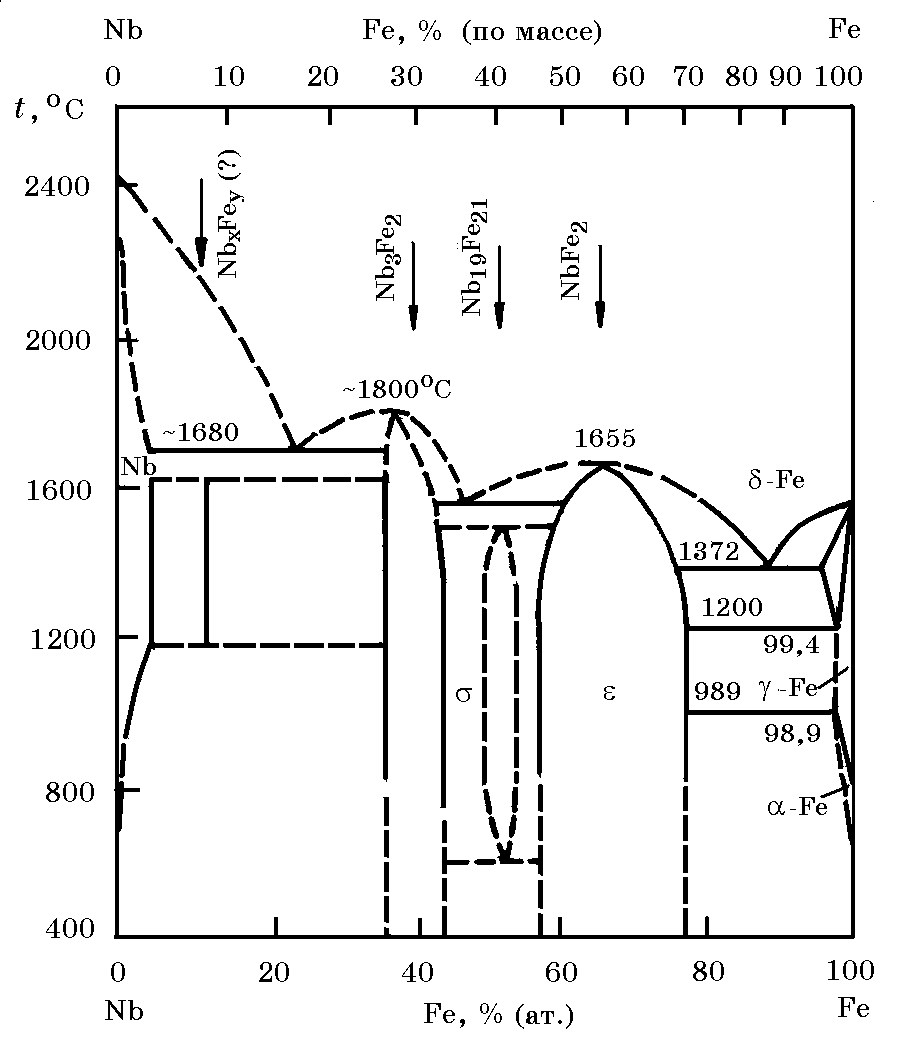
Система Nb–Fe (рис. 12.1). Ниобий с железом образует непрерывные жидкие растворы, в твердом состоянии - соединения Nb3Fe2 (tпл = 1800оС), Nb19Fe21 (tразл = 1500оC), NbFe2 (tпл = 1655оC). Сплавы типа феррониобия с 50–70% (Nb + Ta) имеют температуру плавления (ликвидуса) 1620-1580оС. Теплота образования NbFe2 равна ∆Н = 61,45 Дж/моль. В бинарной системе Nb–Fe имеются три эвтектики.
= 61,45 Дж/моль. В бинарной системе Nb–Fe имеются три эвтектики.
Cистема Nb–C. (рис. 12.2). В системах Nb–C образуются термодинамически прочные карбиды. Карбиды Nb2C (5,43–5,83% C) и NbC (11,45% C, tпл = 3613оС, плотность 7,82 г/см3) образуются по перитектическим реакциям. В системе Nb–C со стороны Nb имеется эвтектика Nb + Nb2C (tэв = 2230оС). Температурные зависимости изменения энергии Гиббса реакций образования Nb2C и NbC из элементов описываются следующими выражениями:
2Nb(т) + C(т) = Nb2C(т);
∆GONb2O = –192600 + 4,18Т Дж/моль;
Nb + C = NbC;
∆GONbC = –130200 + 1,7Т Дж/моль.
Стандартная энтальпия карбида NbC ∆Н = –137,94 кДж/моль, энтропия S
= –137,94 кДж/моль, энтропия S = 35,03 Дж/(моль×K), а карбида Nb2C Н
= 35,03 Дж/(моль×K), а карбида Nb2C Н = –186,01 кДж/моль, S
= –186,01 кДж/моль, S = 63,95 Дж/(моль×K).
= 63,95 Дж/(моль×K).
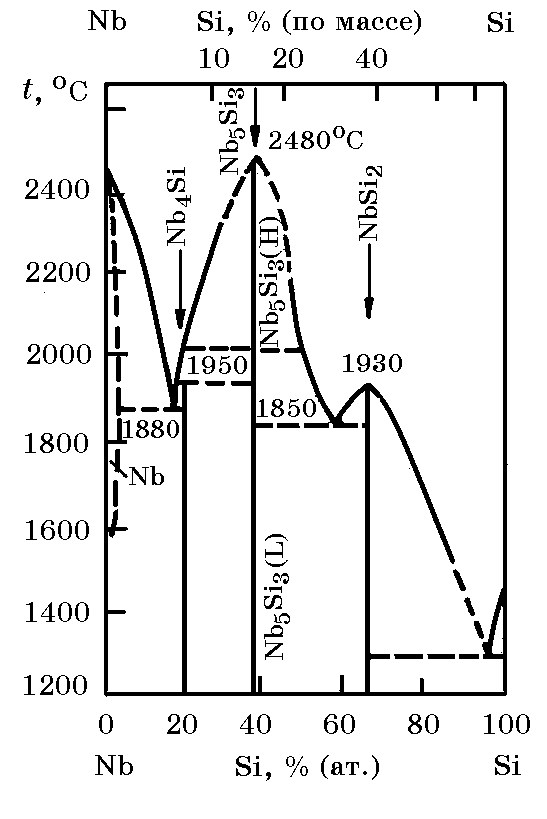
Система Nb–Si (рис. 12.3). Ниобий с кремнием образуют силициды типа Me4Si, Me5Si3, MeSi2, термодинамические свойства которых приведены ниже:

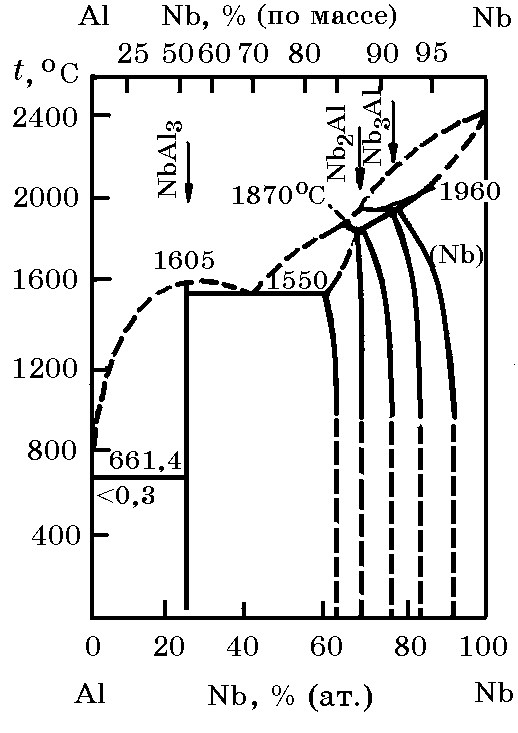
Система Nb–Al (рис. 12.4). В системе Nb–Al образуется ряд алюминидов ниобия NbAl3, Nb2Al и Nb3Al с высокой температурой плавления: 1605оС NbAl3, 1870оС Nb2Al и ~1960оС Nb3Al. В частной системе NbAl3–Nb2Al имеется эвтектика с температурой 1550оС.
Система Nb–P. Ниобий активно взаимодействует с фосфором, образуя термодинамически прочные фосфиды NbP (25% P) и NbP2 (40% P). Фосфид NbP имеет широкую область гомогенности (NbP0,8-1,2).
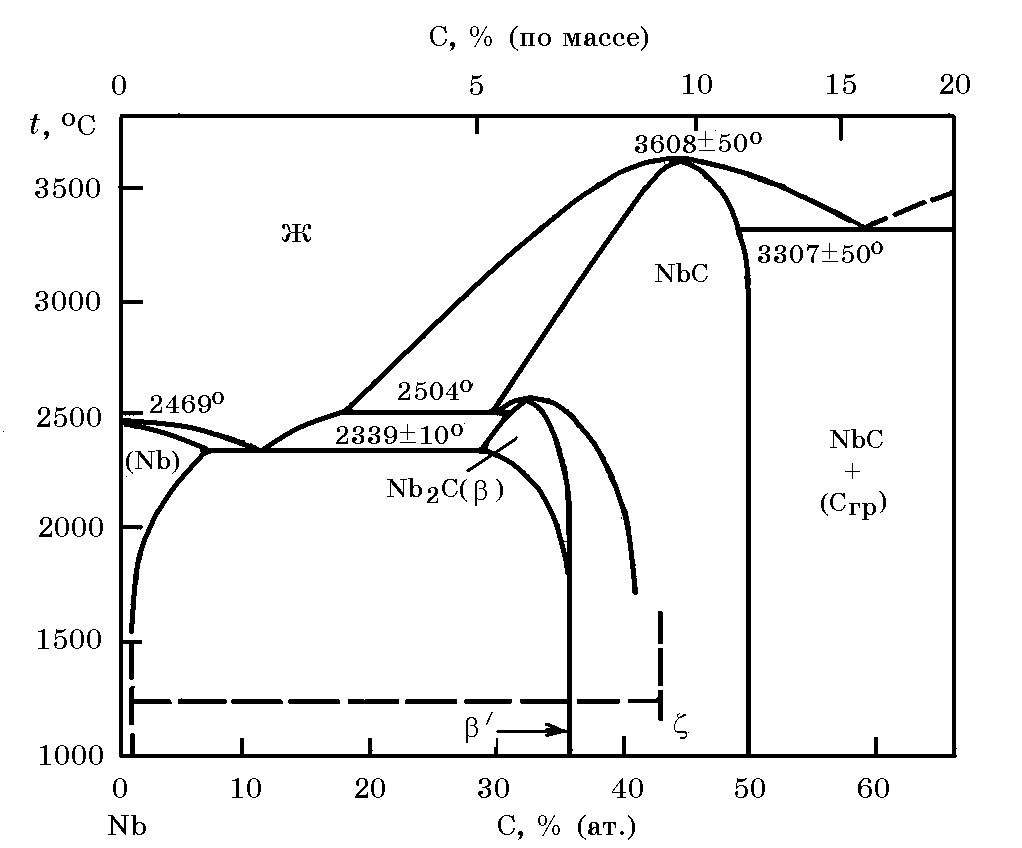
Рис.12.2. Диаграмма равновесного состояния системы Nb–C
(Сгр – графит)
|
|
Рис. 12.3. Диаграмма равновесного cостояния системы Nb–Si |
Рис. 12.4. Диаграмма равновесного состояния системы Nb–Al |
Система Nb–O (рис. 12.5). В этой системе образуются стабильные оксиды NbO (14,69% O, tпл = 1945оC), NbO2 (25,62% O, tпл = 1915оC) и Nb2O5 (30% O, tпл = 1510оC), термодинамические свойства которых приведены ниже:
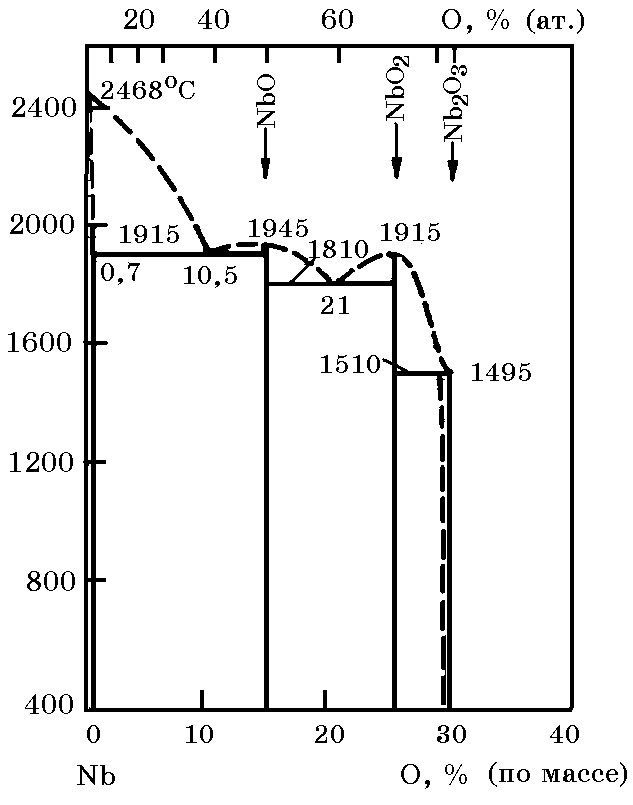
Рис. 12.5. Диаграмма равновесного состояния системы Nb–O
Реакции образования оксидов из элементов характеризуются изменением энергии Гиббса, кДж/моль:
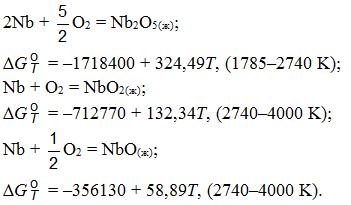
Ниобатные системы. Система Nb2O5–CaO (рис. 12.6). Известен ряд ниобатов кальция: CaO∙Nb2O3 (tпл = 1560оC), 2CaO∙Nb2O5 (tпл = 1567оC) и 3CaO∙Nb2O5 (перитектически разлагается при 1560оС). В системе CaO–Nb2O5 имеется три эвтектики (ТE1 = 1362оС; ТE2 = 1492оС; ТE3 = 1535оС).
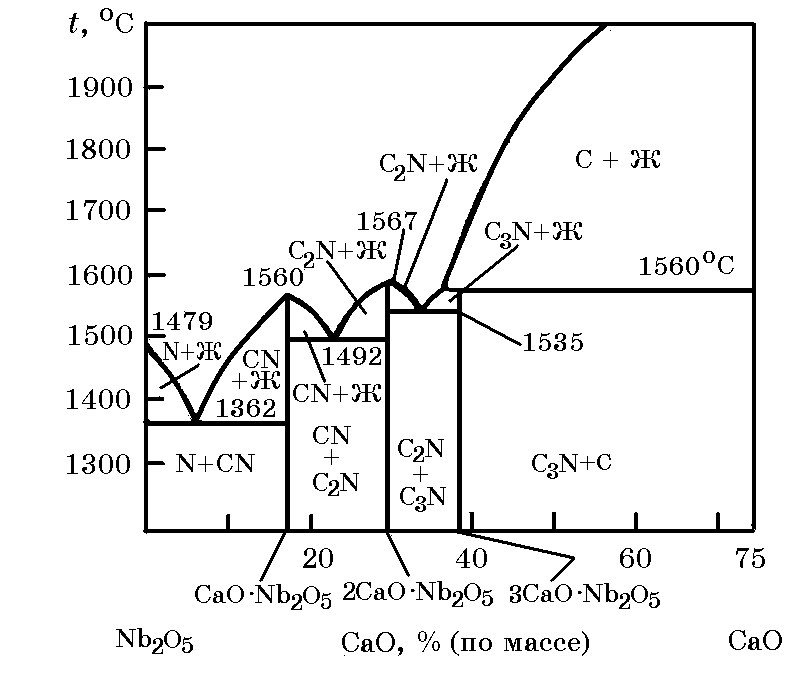
Рис. 12.6. Диаграмма равновесного состояния системы
Nb2O3–CaO
Система Nb2O5–SiO2 (рис. 12.7). Оксиды Nb2O5 и SiO2, имеющие кислотный характер, химических соединений не образуют. В области, богатой Nb2O5, имеется эвтектика (tE1 = 1448оС), а в области высоких содержаний SiO2 также имеется эвтектика tE2 = 1695оС. Выше 1695оС существует большая область двух несмешивающихся жидкостей.
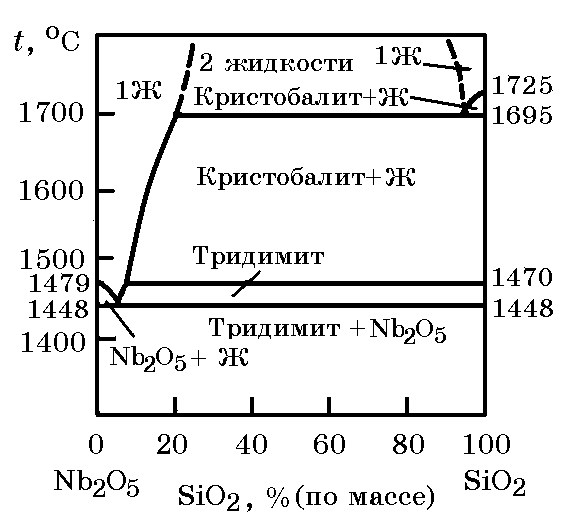
Рис. 12.7. Диаграмма равновесного состояния системы Nb2O5–SiO2
Система Nb2O5–Al2O3 (рис. 12.8). Оксиды Nb2O5 и Al2O3 взаимодействуют с образованием Al2О3×NbO, Al2O3∙9Nb2O5 и Al2O3∙25Nb2O5.
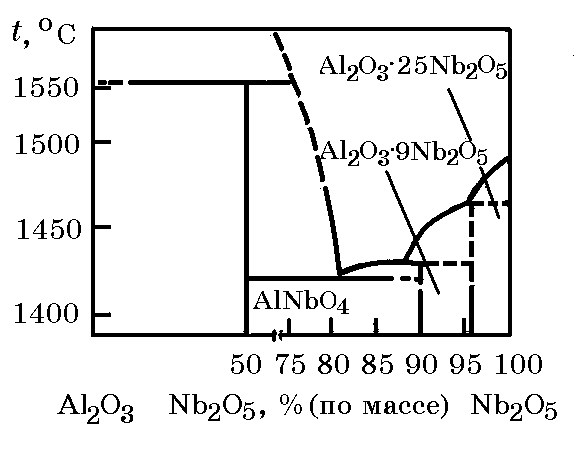
Рис. 12.8. Диаграмма равновесного состояния системы Nb2O5–Al2O3