13.1. Свойства циркония и его соединений |
Содержание > ГЛАВА 13. Электрометаллургия ферросиликоциркония и ферроалюминоциркония > 13.1. Свойства циркония и его соединений
Цирконий элемент IV группы второго большого периода переходных элементов Периодической системы Д.И. Менделеева. Порядковый номер 40; атомная масса 91,22, электронная конфигурация атома 4d25s2, плотность 6,49 г/см3, температура плавления 1855оС, температура кипения 4350оС, валентность 2 и 4. Цирконий существует в двух модификациях: α–Zr c гексагональной решеткой (а = 0,3231 нм, с = 0,5146 нм), плотность 6,5107 г/см3 и β–Zr с кубической решеткой а = 0,361 нм; температура фазового перехода α–Zr ↔ β–Zr равна 863оС.
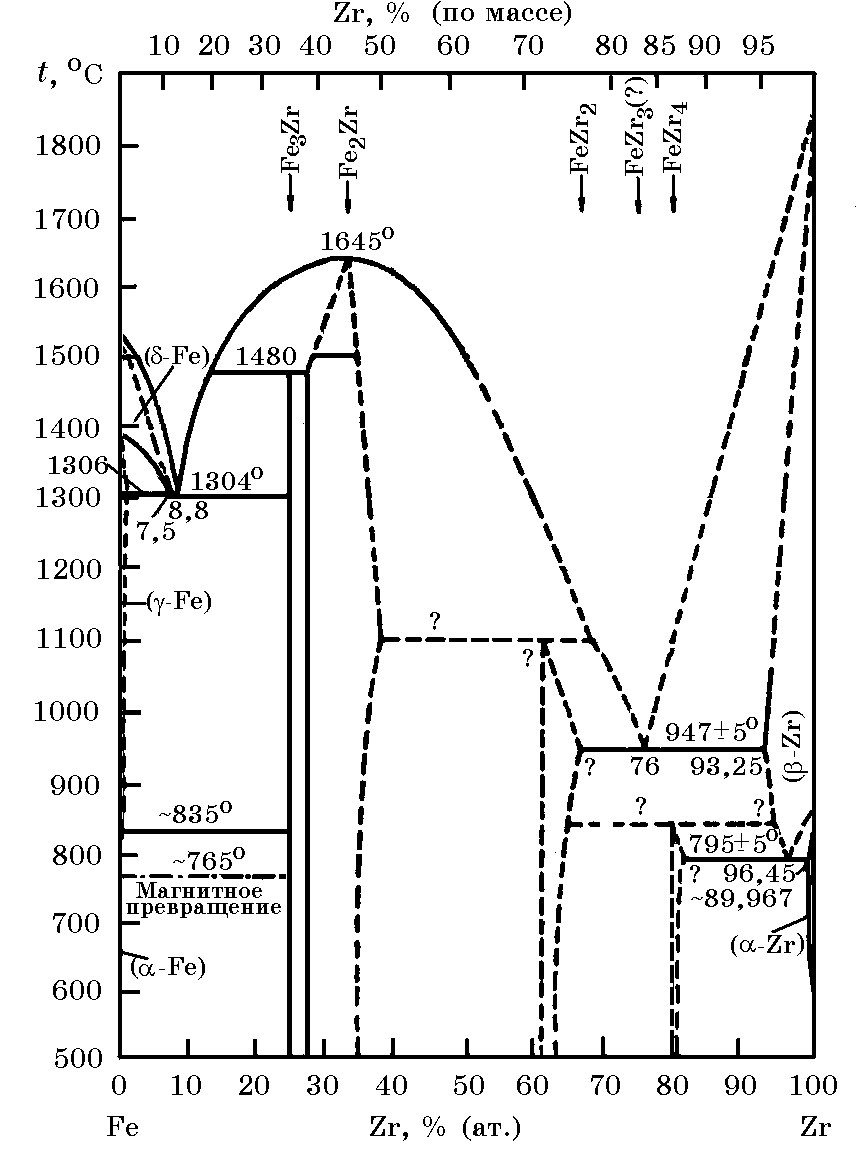
Система Zr–Fe (рис. 13.1). В системе Zr–Fe существуют химические соединения Zr4Fe, Zr3Fe, Zr2Fe, ZrFe2 и ZrFe3, а также две эвтектики с температурами 1304 и 947оС*. Наиболее тугоплавким является соединение ZrFe2 (tпл = 1645оC).
Первая парциальная теплота растворения циркония в жидком железе равна –75±3 кДж/моль. Величина минимальной интегральной энтальпии образования двойных сплавов Zr–Fe при 47% (ат.) Zr составляет –(15±0,4) кДж/моль.
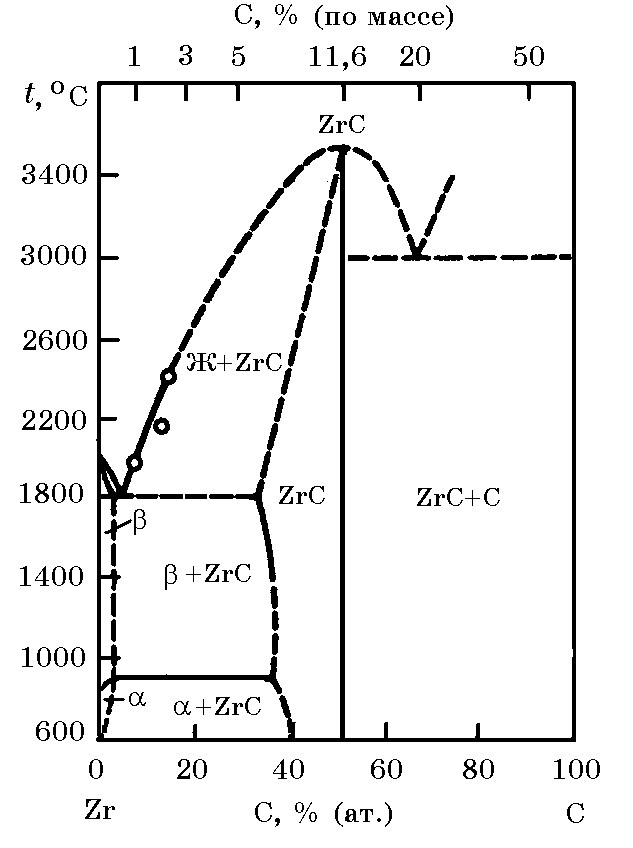
Система Zr–C (рис. 13.2). Цирконий образует с углеродом карбид ZrC с температурой плавления 3530оС, плотностью 6,66 г/см3. Энтальпия образования ZrC ∆Н ообр = –199,86 кДж/моль, энтропия S![]() = 33,14 Дж/(моль×K). Изменение энергии Гиббса реакции образования карбида циркония Zr + C = ZrC в зависимости от температуры описывае
= 33,14 Дж/(моль×K). Изменение энергии Гиббса реакции образования карбида циркония Zr + C = ZrC в зависимости от температуры описывае
 |
 |
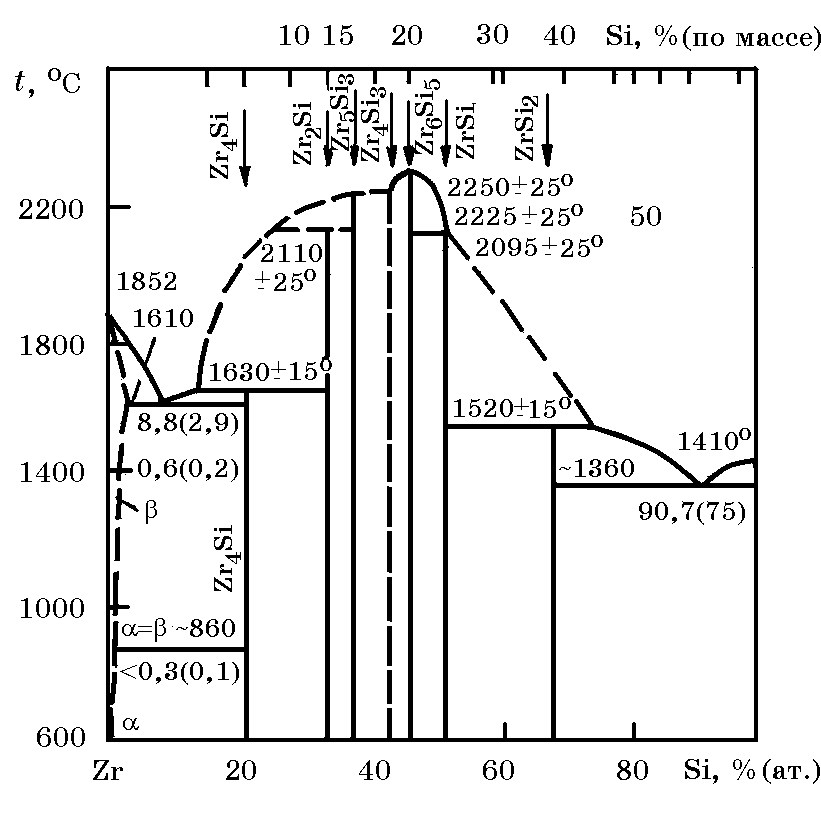 |
Рис. 13.1. Диаграмма равновесного состояния системы Zr–Fe |
Рис. 13.2. Диаграмма равновесного состояния системы Zr–C |
Рис. 13.3. Диаграмма равновесного состояния системы Zr–Si |
тся уравнением ∆G![]() = –184338 + 9,19Т, Дж/моль.
= –184338 + 9,19Т, Дж/моль.
Система Zr–Si (рис. 13.3). Существует ряд силицидов циркония, указанных на диаграмме состояния системы Zr– Si. Наиболее термодинамически прочным является Zr6Si5 (∆H![]() = –841,55 кДж/моль), температура плавления 2250оС. В цирконии растворяется ≤0,2 Si, в кремнии цирконий в составе раствора не обнаружен.
= –841,55 кДж/моль), температура плавления 2250оС. В цирконии растворяется ≤0,2 Si, в кремнии цирконий в составе раствора не обнаружен.
Система Zr–Al (рис. 13.4). Алюминиды циркония многочисленны. Наиболее прочными соединениями в этой системе являются ZrAl3, ZrAl2 и Zr3Al2 с температурой плавления 1580, 1645 и 1595оС соответственно. Растворимость алюминия в α–Zr составляет 3,5% мас., алюминий в β–Zr растворяется в количестве 0,14%.
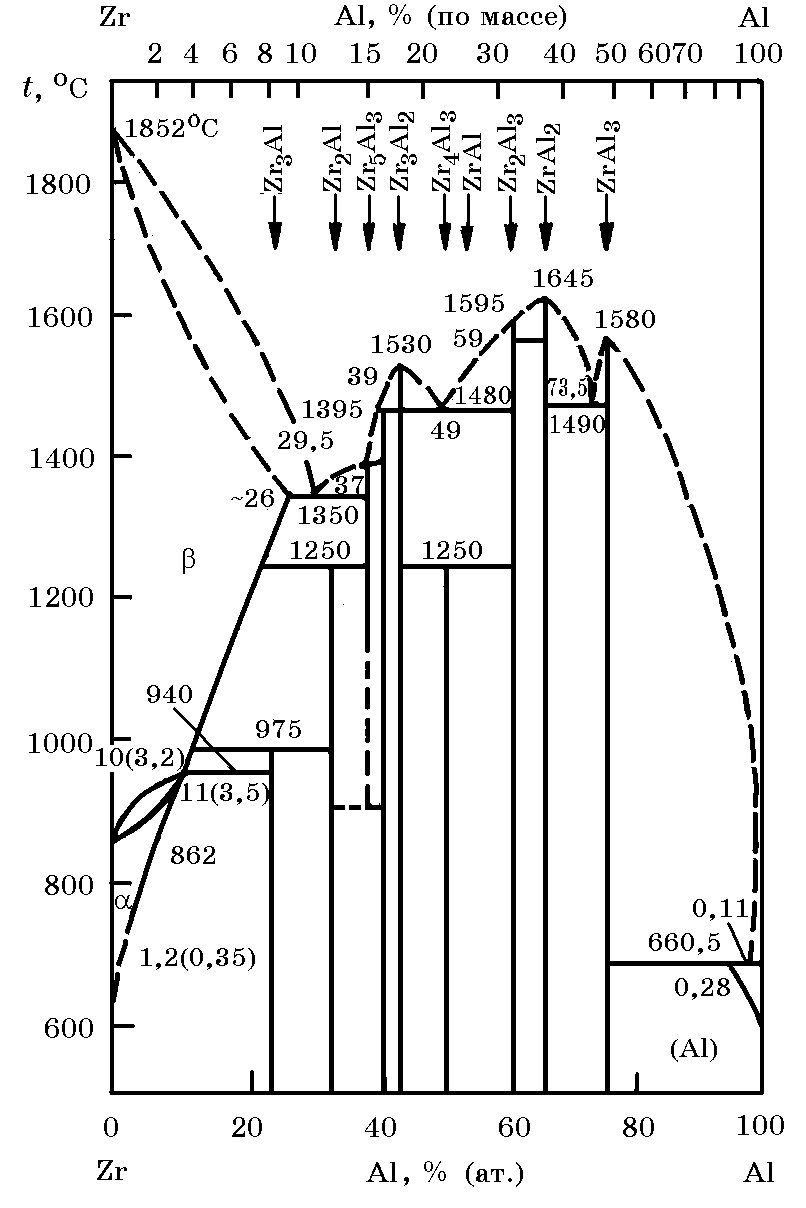
Рис. 13.4. Диаграмма равновесного состояния системы Zr–Al
Система Zr–O (рис. 13.5*). Известны оксиды ZrO2 (∆Н ообр = –1099 кДж/моль, S![]() = 50,66 Дж/(моль×К) и ZrO. Для реакции Zr + O2 = ZrO2 ∆G
= 50,66 Дж/(моль×К) и ZrO. Для реакции Zr + O2 = ZrO2 ∆G![]() = –1099758 + 177,9Т (177–2273 K).
= –1099758 + 177,9Т (177–2273 K).
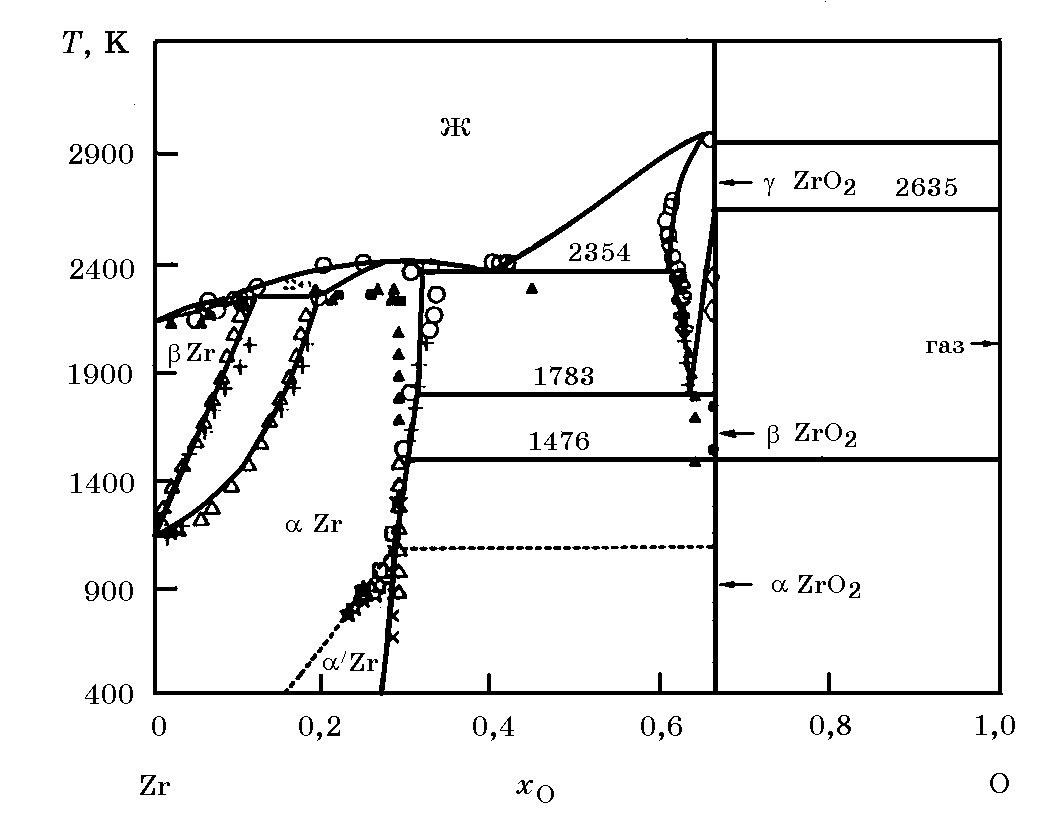
Рис. 13.5. Диаграмма равновесного состояния системы Zr–O
Диоксид циркония является полиморфным оксидом. При комнатной температуре устойчива моноклинная α-ZrO2. Выше 1205оС α-ZrO2 превращается в тетрагональную, форму β–ZrO2, устойчивую до 2330оС. При t>2330оС β–ZrO2 переходит в кубическую модификацию γ–ZrO2. Для превращений α–ZrO2 ↔ β–ZrO2 характерно наличие гистерезиса, т.е. несовпадения температурных интервалов прямого и обратного перехода. Для кристаллов одинаковой чистоты температура α ↔ β-перехода изменялась от 1160 до 1190оС, а для β ↔ α–перехода для этих же кристаллов в пределах от 1070 до 1100оС. Энантиотропное (т.е. обратимое) γ ↔ β–превращение ZrO2 происходит при 2330оС с минимальным гистерезисом 30оС.
Система ZrO2–SiO2 (рис. 13.6). В системе ZrO2–SiO2 образуется одно соединения ZrO2∙SiO2. В природе широко распространен минерал циркон ZrO2∙SiO2, в котором некоторое количество циркония может замещаться гафнием и торием. Циркон обычно относится к россыпным месторождениям, где он ассоциирует с другими устойчивыми минералами.
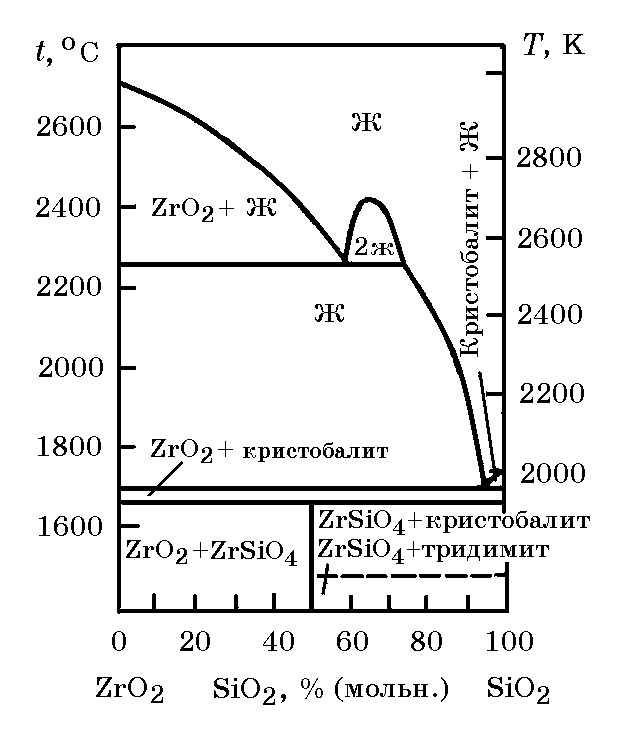
Рис. 13.6. Диаграмма равновесного состояния системы ZrO2–SiO2
Система ZrO2–Al2O3 (рис. 13.7). Диаграмма состояния системы ZrO2–Al2O3 имеет простой эвтектический вид.
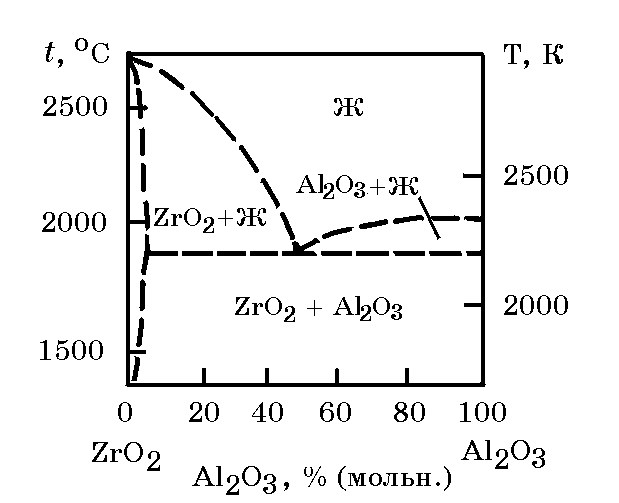
Рис.13.7. Диаграмма равновесного состояния системы ZrO2–Al2O3
Система ZrO2–CaO (рис. 13.8). В системе ZrO2–CaO образуются соединения CaZrO3 и CaZr4O9, а также ряд твердых растворов CaO в ZrO2 моноклинной, тетрагональной и кубической кристаллических структур.