Система Al–Si(рис.15.1). Диаграмма состояния системы Al–Si эвтектического типа. Эвтектика имеет координаты tэв = 577°С и 12% Si. Растворимость кремния в твердом алюминии при эвтектической температуре составляет ~ 1,5%.
15.1. Свойства алюминия и его соединений |
Содержание > ГЛАВА 15. Электрометаллургия силикоалюминия > 15.1. Свойства алюминия и его соединений
Алюминий элемент ІІІ группы Периодической системы Д.И.Менделеева. Порядковый номер 13, атомная масса 26,98, конфигурация внешней электронной оболочки 6s2, кристаллическая решетка гранецентрированного куба (а = 0,4040 нм), температура плавления 660°С, температура кипения 2452°С, плотность 2,69 г/см3. С OP = 24,35 Дж/(моль×K), S![]() = 28 Дж/(моль×K).
= 28 Дж/(моль×K).
Система Al–Si(рис.15.1). Диаграмма состояния системы Al–Si эвтектического типа. Эвтектика имеет координаты tэв = 577°С и 12% Si. Растворимость кремния в твердом алюминии при эвтектической температуре составляет ~ 1,5%.
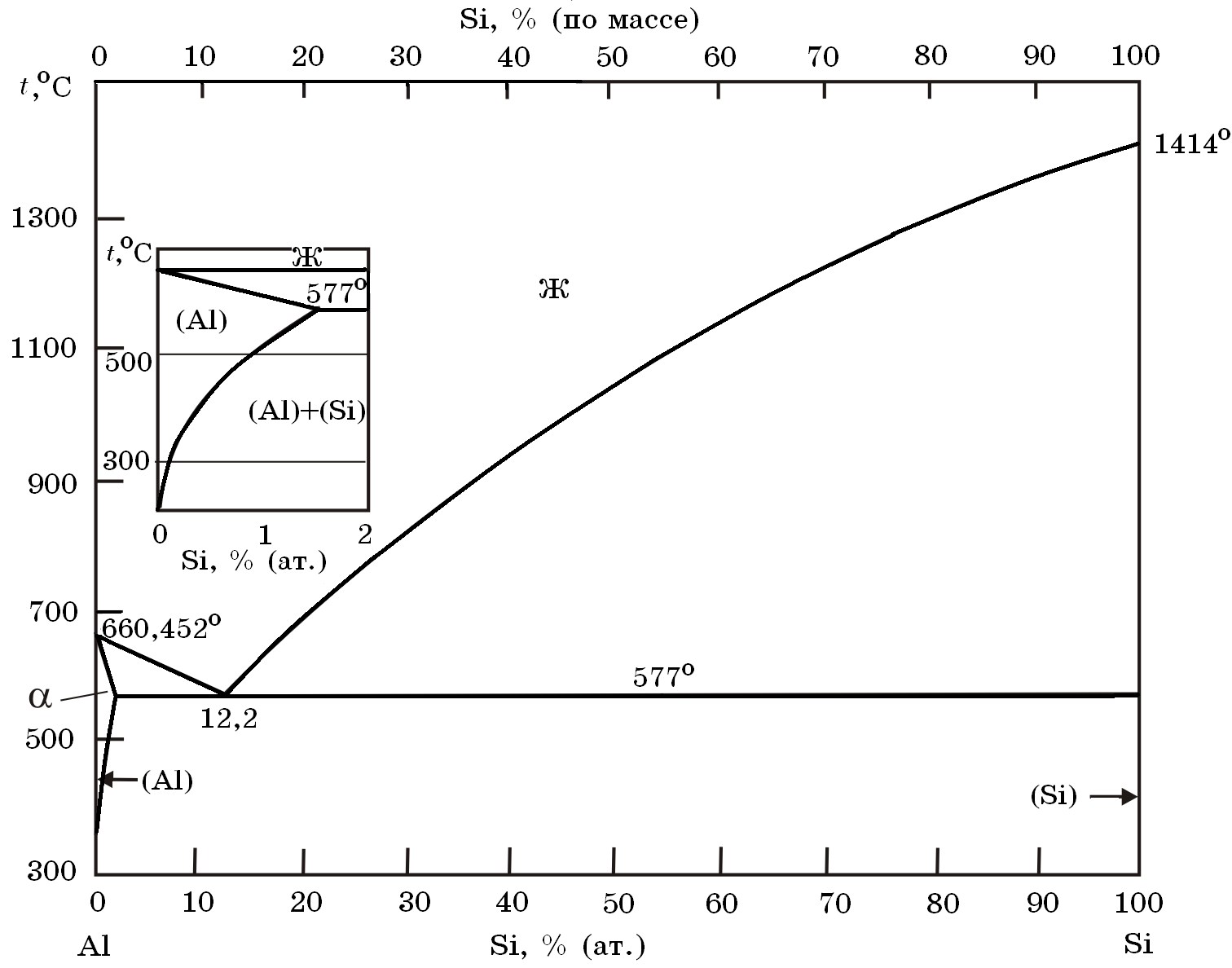
Рис. 15.1. Диаграмма равновесного состояния системы Al–Si
Система Al–C (рис. 15.2). Взаимодействие алюминия с углеродом сопровождается образованием карбида Al4C3 по реакции:
4Alж + 3Ст = Al4C3; ∆G![]() = –215688 + 41,8Т, Дж/моль.
= –215688 + 41,8Т, Дж/моль.
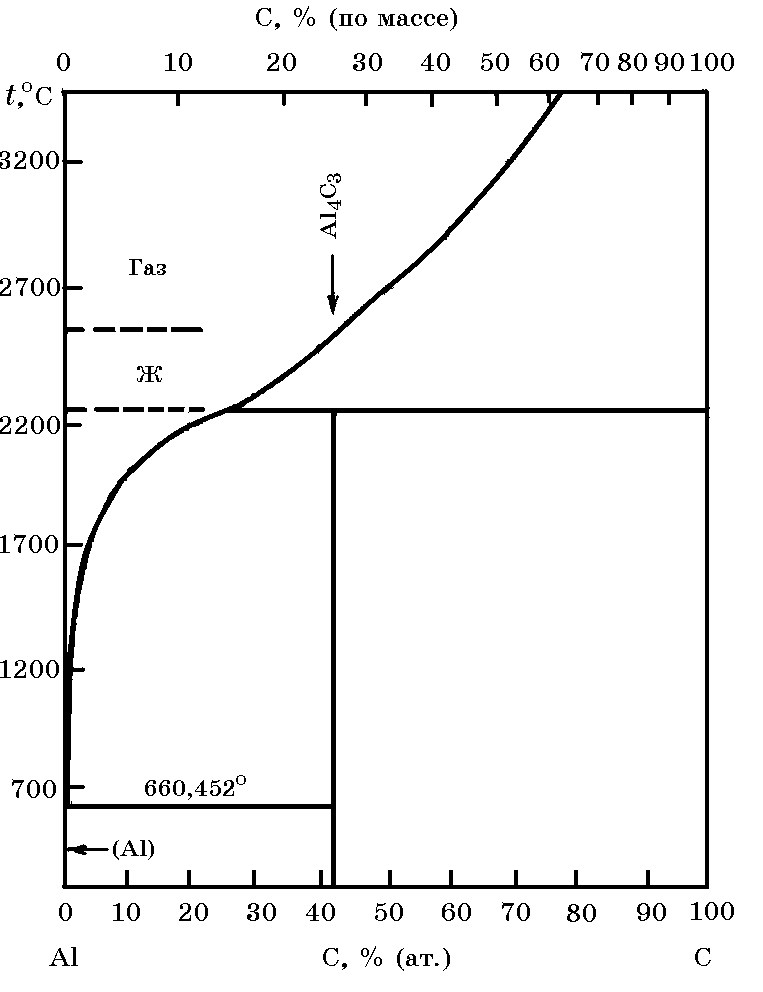
Рис. 15.2. Диаграмма равновесного состояния система Al–C
Растворимость С в жидком Al незначительна, что следует из приведенных данных:
Система Al–Si–C (Al4C3–SiC) (рис. 15.3). В тернарной системе образуются два тройных соединения Al4SiC4 (15,46% Al, 15,35% Si, 26,22% C) и Al8SiC7 (68,5% Al, 8,54% Si, 25,61% C), которые инконгруэнтно плавятся при 2350 и 2360 K соответственно.
Система Al–Ca(рис. 15.4). При выплавке силикоалюминия для последующего металлургического передела с целью получения литейных сплавов, кальций рассматривается как примесный элемент. В связи с этим представляет интерес знание равновесия фаз в системе Al–Ca.
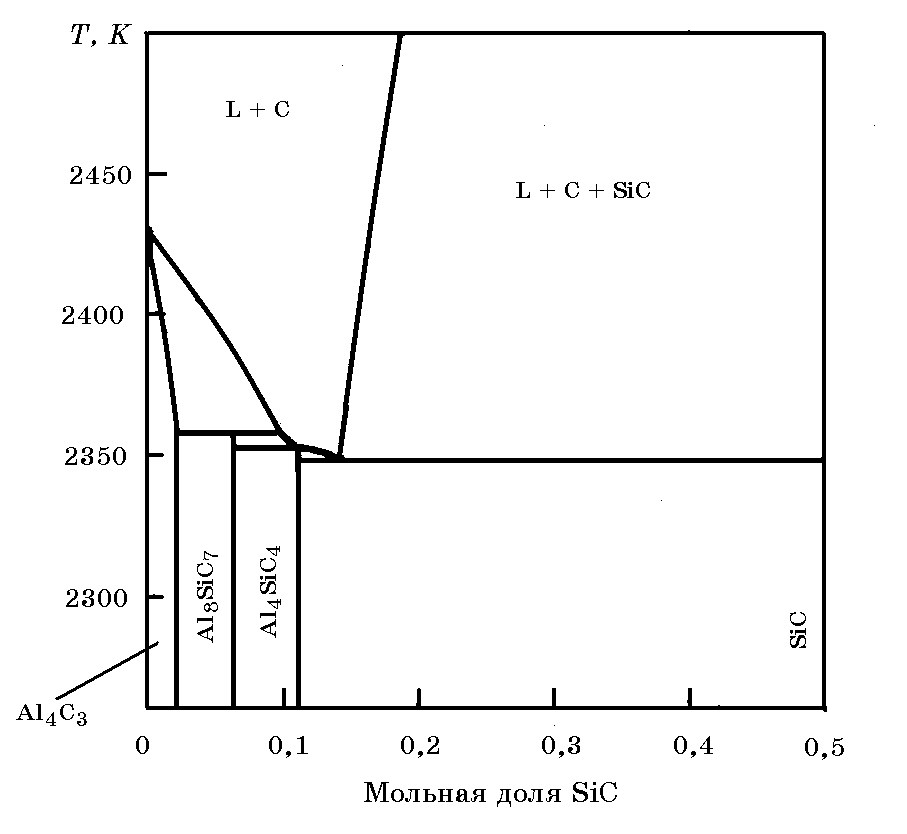
Рис. 15.3. Диаграмма фазовых равновесий в системе Al4C3–SiC
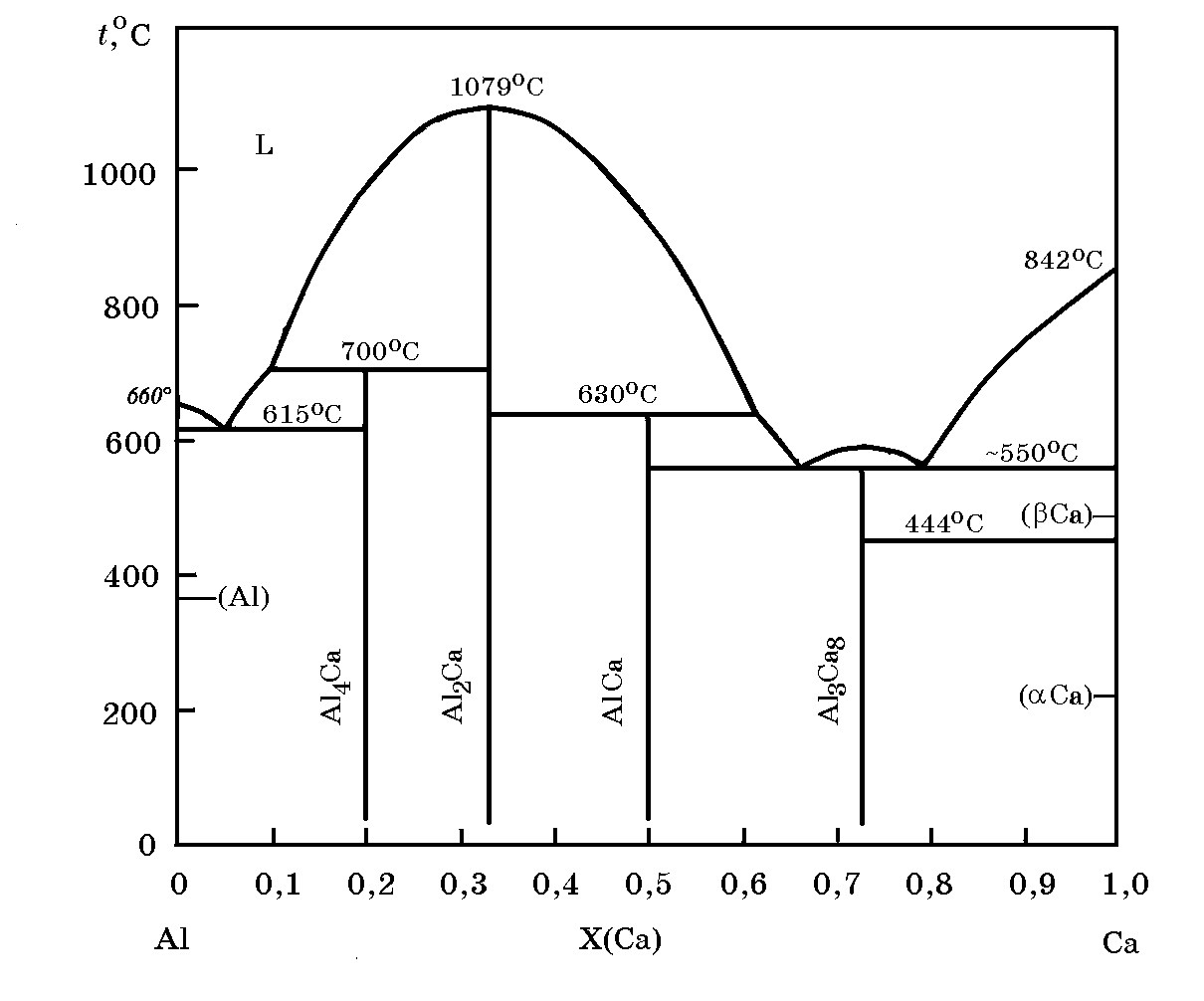
Рис. 15.4. Диаграмма равновесного состояния системы Al–Ca
Как следует из рис. 15.4 в системе образуется ряд алюминидов кальция, среди которых наиболее «тугоплавким» является Al2Ca (57,44% Al, 42,56% Са) (tпл = 1079°С). В системе имеются три эвтектики, одна с температурой плавления 615°С и две с близкими температурами около 550°С.
Зависимости изменения энергии Гиббса образования алюминидов кальция от температуры описываются уравнениями (в Дж/моль):
∆G°(Al4Ca) = –28968 + 15,296T,
∆G°(Al2Ca) = –41732 + 19,156T/
Система Al–O (рис. 15.5). Высший оксид Al2O3 (0,53% Al) плавится при 2054°С, а кипит при 2452°C. Зависимость изменения энергии Гиббса реакции образования Al2O3 от температуры в интервале 1500-2000 K и описывается уравнением:
4/3Alж + О2 = 2/3Al2O3;
∆G![]() = –636210 – 10,47ТlgT + 223Т, Дж/моль.
= –636210 – 10,47ТlgT + 223Т, Дж/моль.
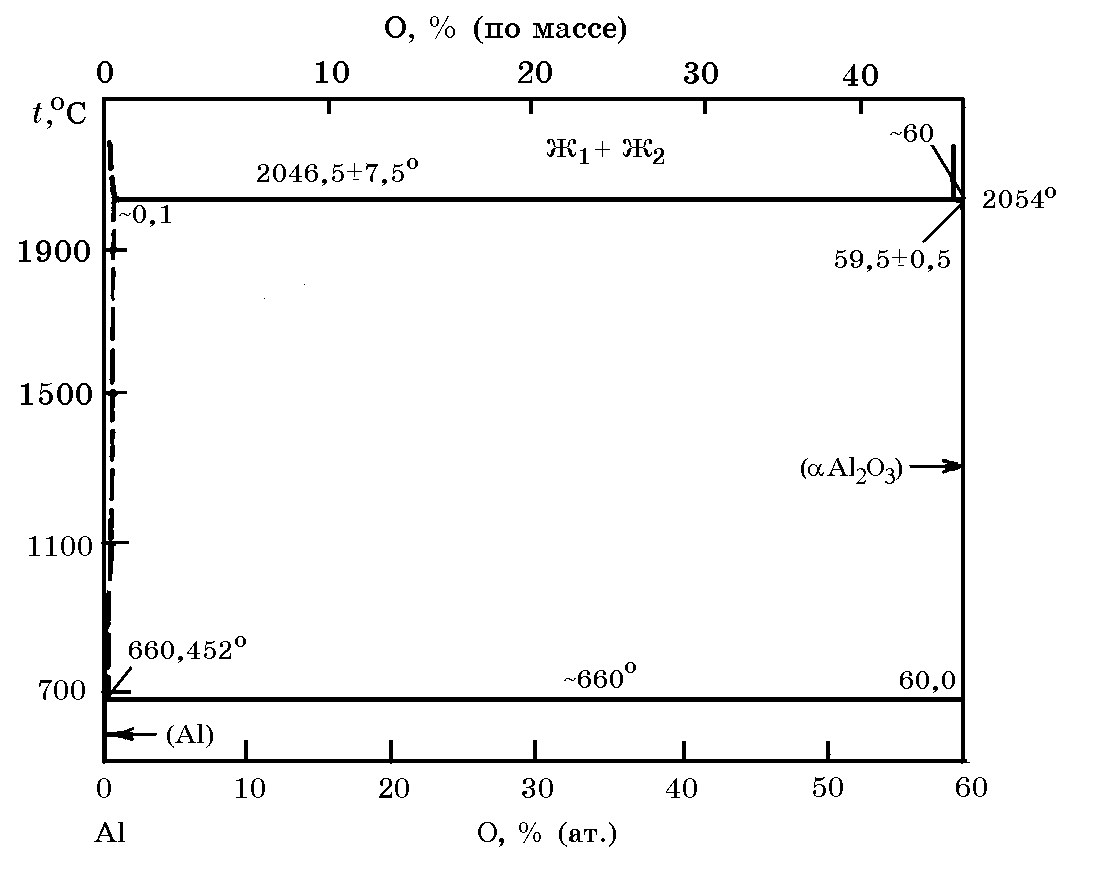
Рис. 15.5. Диаграмма равновесного состояния системы Al–O
При высоких температурах в зависимости от окислительно-восстановительного потенциала газовой фазы в парообразном состоянии могут находиться субсоединения AlO, Al2O и Al2O2.
Система Al–O–C (Al2O3–Al4C3) (рис. 15.6). При восстановлении алюминия из Al2O3 углеродом создаются термодинамические условия для образования тугоплавких оксикарбидов Al4O4C (58,6% Al, 34,7% O и 6,52% С) и Al2OC (65,8% Al, 19,51% O и 14,69% С). Тетракарбид Al4O4C устойчив до 1890°С. При этой температуре он перитектически превращается в Al2OC и жидкость. Монооксикарбид Al2OC при ~ 2000°С также перитектически превращается в карбид Al4C3 и жидкость. Эвтектика состава Al2O3+Al4O4C плавится при ~1835°С.
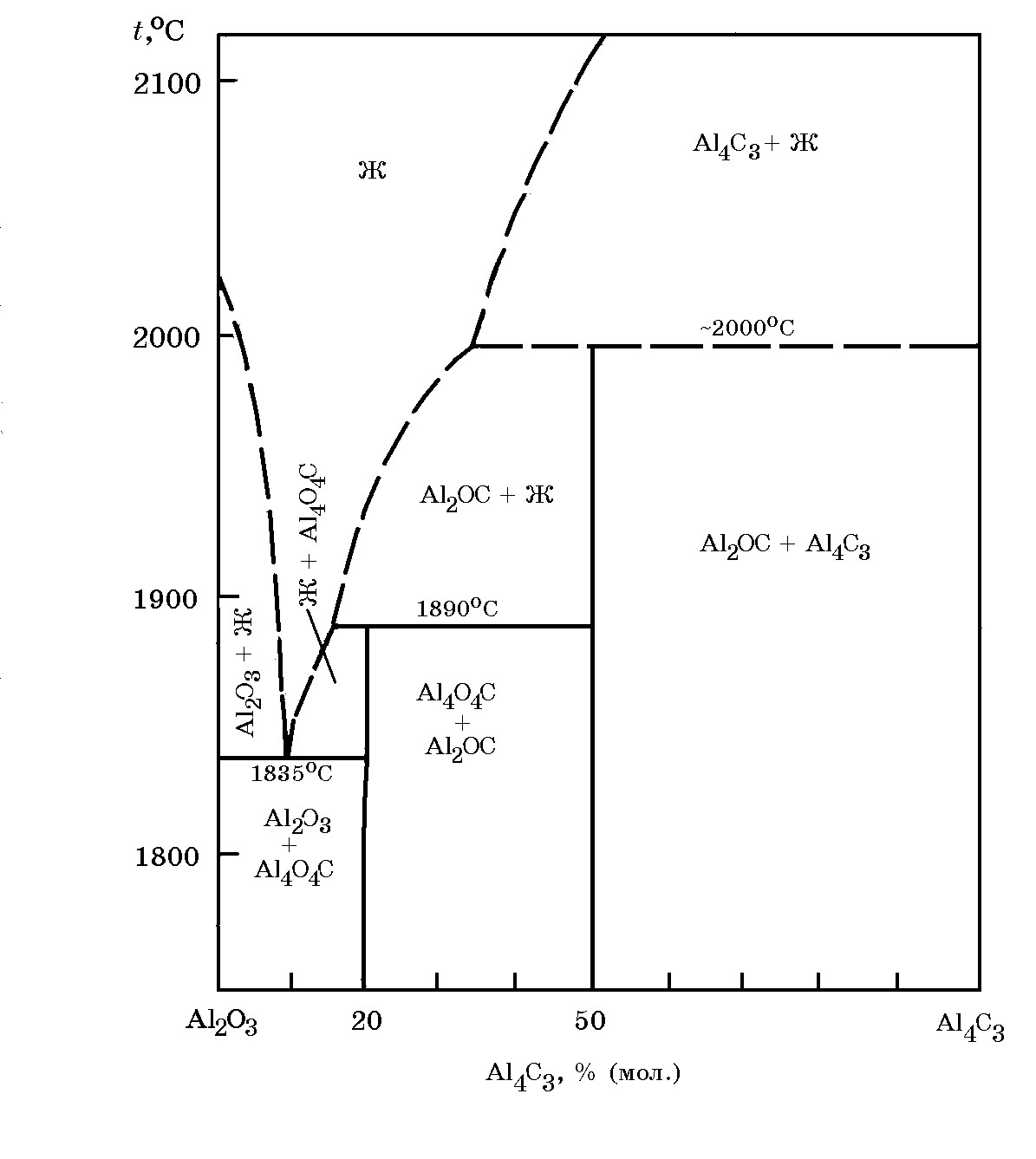
Рис. 15.6. Диаграмма фазовых равновесий в система Al2O3– Al4C3