17.1. Свойства бора и его соединений |
Содержание > ГЛАВА 17. Электрометаллургия ферробора и карбида бора > 17.1. Свойства бора и его соединений
Бор элемент ІІІ группы элементов Периодической системы Д.И.Менделеева. Порядковый номер бора 3, атомная масса 10, 811, температура плавления 2074°С, температура кипения 3658°С, конфигурация внешней электронной оболочки 2s22p, степень окисления 3. Известно более 10 аллотропных модификаций бора. Природный бор состоит из двух стабильных изотопов 6/10В (19,57%) и 11/5В (80,43%). Поперечное сечение захвата тепловых нейтронов 6/10В 3×10-25 м2, 11/5В 4×10-32 м2. Стандартная энтропия бора S![]() = 5,85 Дж/(моль×K).
= 5,85 Дж/(моль×K).
Система В–Fe(рис. 17.1). Бор с железом образует соединения – бориды Fe2B, FeB и FeB2. Некоторые свойства боридов железа приведены в табл. 17.1.
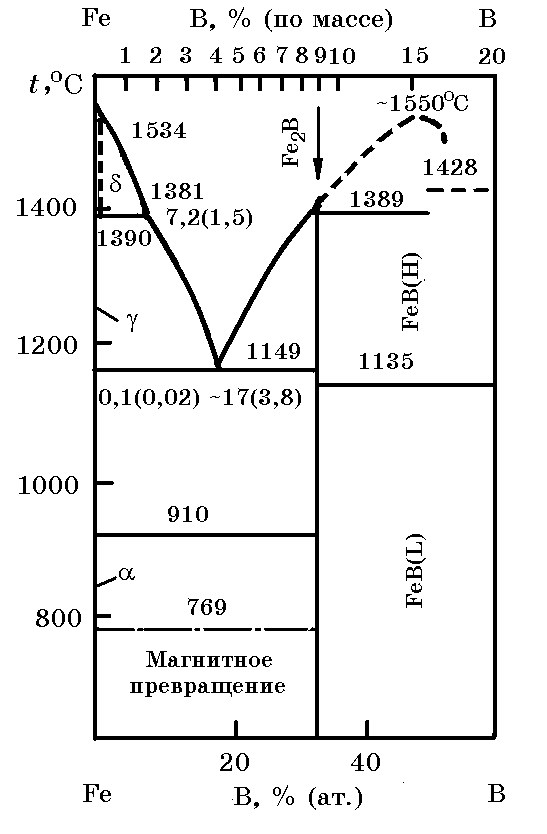
Рис. 17.1. Диаграмма равновесного состояния системы Fe–B
Таблица 17.1. Некоторые свойства боридов железа
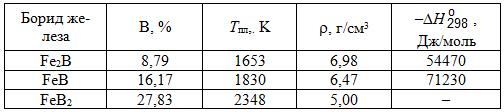
Борид Fe2B плавится инконгруэнтно при 1389°С, а борид FeB2 – конгруэнтно при ~ 1550°С. Бориды железа – термодинамически прочные химические соединения. Энтальпия образования ∆Н![]() = –71,06 кДж/моль, энтропия S
= –71,06 кДж/моль, энтропия S![]() = 56,59 Дж/(моль×K). Растворение бора в жидком железе сопровождается выделением большого количества тепла (см. табл. 17.1).
= 56,59 Дж/(моль×K). Растворение бора в жидком железе сопровождается выделением большого количества тепла (см. табл. 17.1).
Парциальные и интегральные энтальпии образования жидких сплавов бора с железом приведены ниже (при 1680°С, в кДж/моль):
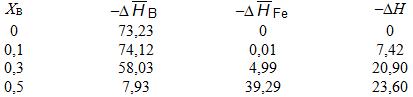
Система В–С (рис. 17.2). В этой системе образуются карбид В4С, имеющий широкую концентрационную область гомогенности. Теплота образования карбида В4С из элементов ∆Н![]() = –71,48 кДж/моль, стандартная энтропия S
= –71,48 кДж/моль, стандартная энтропия S![]() = 27,08 Дж/(моль×K), что свидетельствует о его термодинамической прочности. Температура плавления карбида бора ~2450°С.
= 27,08 Дж/(моль×K), что свидетельствует о его термодинамической прочности. Температура плавления карбида бора ~2450°С.
Система В–Si(рис. 17.3). Бор с кремнием образует термодинамически прочные соединения – силициды бора SiB3, SiB6 и SiBn. Силицид SiB6 плавится инконгруэнтно при 1850°С.
Система В–Al (рис.17.4). Известны алюминиды бора AlB2, AlB10 и AlB12. Алюминид AlB2 плавится инконгруэнтно при 960°С, а AlB12 – конгруэнтно при 2150°С. Cоединение AlB10 существует в узком температурном интервале 1660–1850°С.
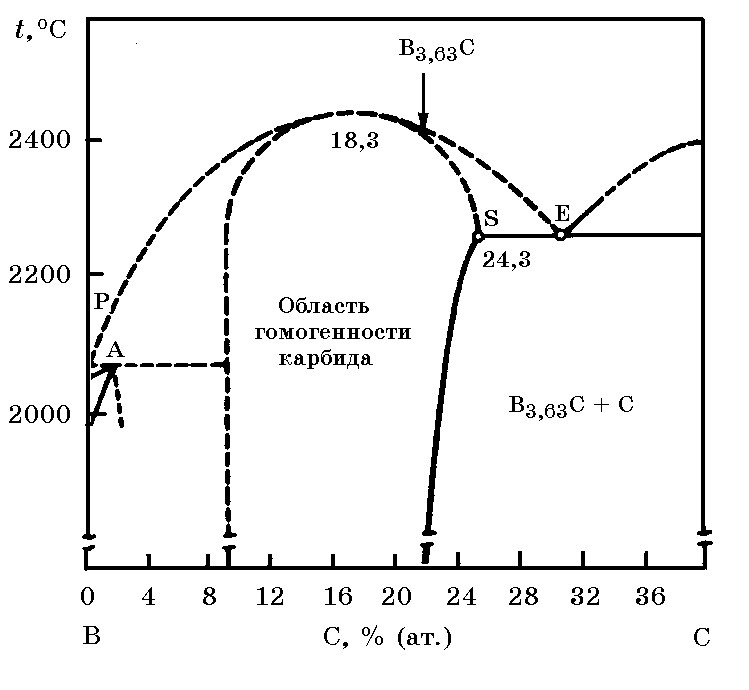
Рис. 17.2. Диаграмма равновесного состояния системы В–С
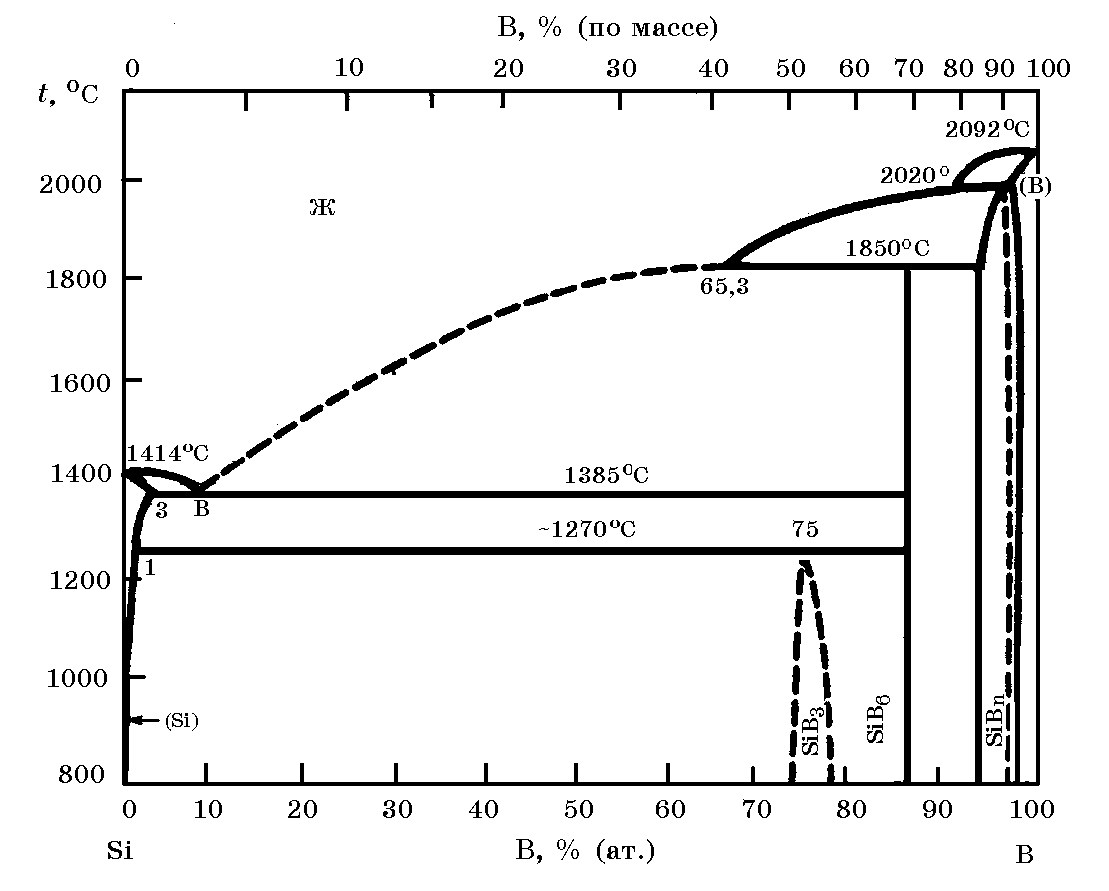
Рис. 17.3. Диаграмма равновесного состояния системы В–Si
Система В–О. В системе В–О известен ряд оксидов с различным отношением В:О, от 7 : 1 до 4 : 5. Термически наиболее устойчивым является В2О3. Температура плавления В2О3 равна 450°С. Взаимодействие бора с молекулярным кислородом, описывается реакцией:
4/3В + О2 = 2/3В2О3; ∆G![]() = –847146 + 144,3Т, Дж/моль.
= –847146 + 144,3Т, Дж/моль.
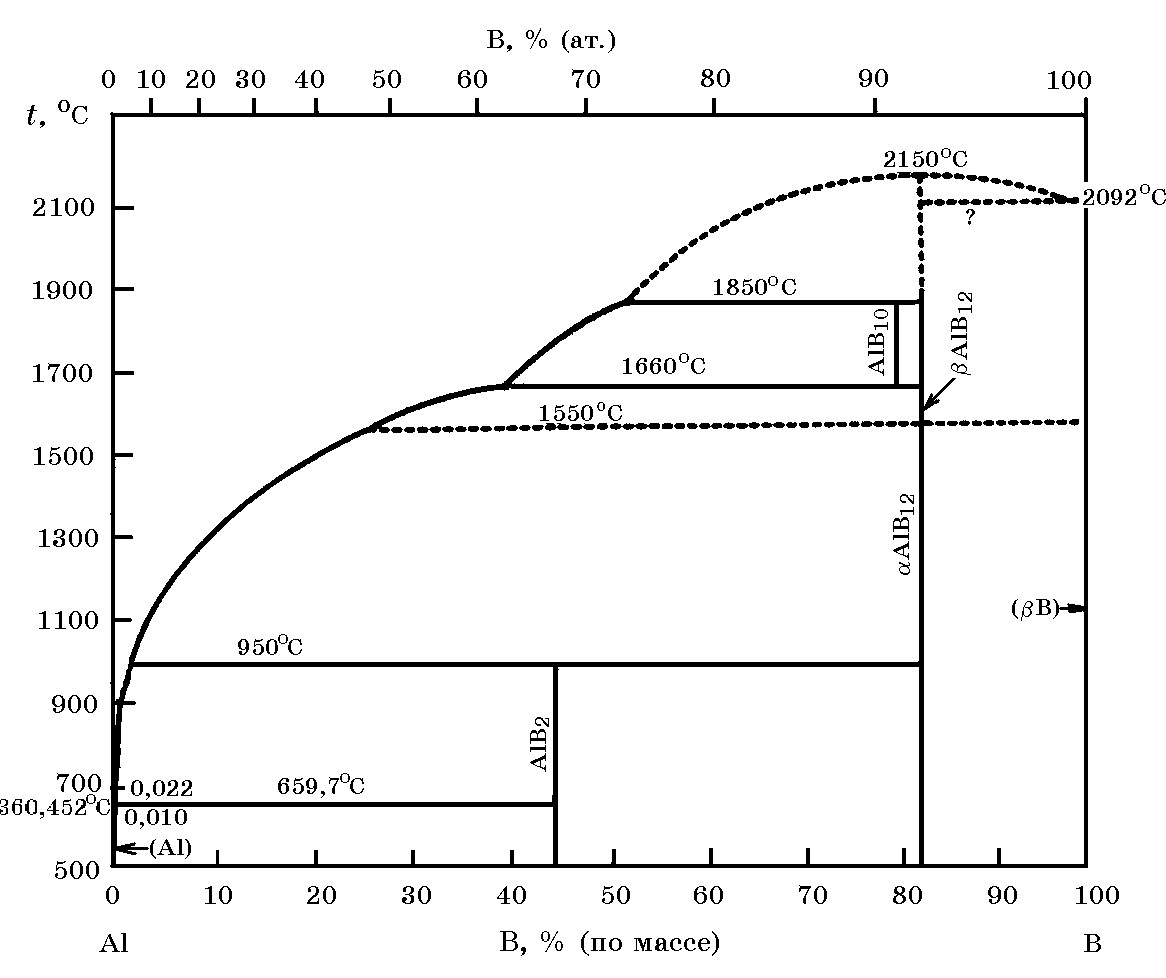
Рис. 17.4. Диаграмма равновесного состояния системы В–Al
Давление пара В2О3 зависит от температуры, и эта связь описывается уравнением:
lgPобщ (Па) = -19000/Т + 12,771.
Теплота сублимации В2О3; ∆Носуб = 375,14 кДж/моль.