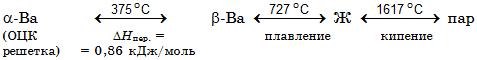
18.1. Свойства ферросиликобария и алюминобария |
Содержание > ГЛАВА 18. Электрометаллургия ферросплавов со щелочноземельными и редкоземельными металлами > 18.1. Свойства ферросиликобария и алюминобария
Физико-химические свойства бария. Барий – химический элемент ІІ группы Периодической системы элементов Д.И.Менделеева, атомный номер 56, атомная масса 137,33, относится к щелочноземельным металлам, плотность 3,78 г/см3. Природный барий состоит из семи стабильных изотопов 130, 132, 134–137 и 138 (массовая доля изотопа 71,66%). Конфигурация внешней электронной оболочки атома бария 6s2, степень окисления 2, редко 1. Барий существует в двух аллотропных модификациях. Ниже приведены температуры фазовых переходов бария:
Тройная точка бария (равновесия трех фаз твердое – жидкое – парообразное состояние: температура 710°С, давление 1,185 Па. Уравнение температурной зависимости давления пара над жидким барием для интервала температур (983–1959 К) имеет вид:
lgPг (мм.рт.ст) = 20,408 – 8304/Т – 4,036 lgT.
Термодинамические константы бария: С cP = 28,1 Дж/(моль×K), S![]() = 62,5 Дж/(моль×K).
= 62,5 Дж/(моль×K).
Система Ва–О. В системе образуется оксид ВаО (89,57% Ва и 10,43% О), представляющий собой бесцветные кристаллы с кубической решеткой (а = 0,5542 нм), плотностью 5,7 г/см3. При нагревании ВаО в среде О2 около 500о получают пероксид ВаО2 – также бесцветные кристаллы, но с гексагональной решеткой (а = 0,534 нм, с = 0,677 нм), плотностью 4,96 г/см3, ∆Н ообр = –623,0 кДж/моль, S![]() = 91,13 Дж/(моль×K). Выше 500°С ВаО2 термически диссоциирует с образованием ВаО и О2. ВаО2 – компонент шихты для получения лигатуры Al–Ba.
= 91,13 Дж/(моль×K). Выше 500°С ВаО2 термически диссоциирует с образованием ВаО и О2. ВаО2 – компонент шихты для получения лигатуры Al–Ba.
Температура плавления ВаО 2017°С, при нагревании возгоняется, ∆Н овозг = 424,3 кДж/моль, энтропия S![]() = 70,34 Дж/(моль×K). Энтальпия образования оксида ВаО ∆Н
= 70,34 Дж/(моль×K). Энтальпия образования оксида ВаО ∆Н![]() = –553,02 кДж/моль. Получают ВаО термическим разложением карбоната ВаСО3 при 700-900°С.
= –553,02 кДж/моль. Получают ВаО термическим разложением карбоната ВаСО3 при 700-900°С.
Зависимость изменения энергии Гиббса реакций образования ВаО от температуры описывается уравнениями (Дж/моль):
2Ватв + О2 = 2ВаОтв;
∆G![]() = –1135288 + 193,05T (298-983 K);
= –1135288 + 193,05T (298-983 K);
2Важ + О2 = 2ВаОтв;
∆G![]() = –1138808 +227,78T (983-1900 K).
= –1138808 +227,78T (983-1900 K).
Условие ∆G![]() = 0 при РO2 = 101 кПа для приведенных реакций выполняется при 5880 и 4990 K соответственно. Уравнение температурной зависимости давления пара над твердым ВаО имеет вид (для интервала температур 1200–1700 K):
= 0 при РO2 = 101 кПа для приведенных реакций выполняется при 5880 и 4990 K соответственно. Уравнение температурной зависимости давления пара над твердым ВаО имеет вид (для интервала температур 1200–1700 K):
lgP (Па) = 10,99 – 19700/Т.
Система ВаО–СО2. Карбонат бария ВаСО3 (77,69% ВаО, 0,22% СО2) существует в двух модификациях: до температуры 840°С устойчива модификация α-ВаСО3 с ромбической решеткой (а = 0,639 нм, в = 0,883 нм; с = 0-,528 нм); в интервале 840–960°С – с гексагональной решеткой; при 982°С – γ-ВаСО3 с кубической решеткой. Энтальпия перехода α-ВаСО3 → β-ВаСО3 ∆Н o = 16,3 кДж/моль. Энтропия α-ВаСО3S ![]() = 112,1 Дж/(моль×K). Зависимость теплоемкости α-ВаСО3 от температуры имеет вид:
= 112,1 Дж/(моль×K). Зависимость теплоемкости α-ВаСО3 от температуры имеет вид:
СP = 20,77 + 11,70 Т – 2,86 Т-2, кал/(моль×K).
При нагревании выше 964 K ВаСО3 диссоциирует с образованием ВаО и СО2.
Уравнение температурной зависимости давления СО2 над ВаСО3 имеет вид
lgPCO2(мм рт.ст.) = –11,30 + 13670/Т.
ВаСО3 образует твердые растворы со SrCO3, CaCO3 и ВаО. Карбонат бария токсичен; ПДК = 0,5 г/см3.
Бария гидрооксид. Ва(ОН)2 существует в двух модификациях; низкотемпературная модификация α-Ва(ОН)2 при 246°С переходит в β-Ва(ОН)2; DНпер. = 3,6 кДж/моль. Температура плавления Ва(ОН)2 408°С, ∆Н ообр = –941,6 кДж/моль, S![]() = 108,5 Дж/(моль×K). При нагревании разлагается на ВаО и Н2О, около 800°С разлагается полностью до ВаО. Уравнение температурной зависимости давления пара над твердым и жидким Ва(ОН)2 имеют вид соответственно:
= 108,5 Дж/(моль×K). При нагревании разлагается на ВаО и Н2О, около 800°С разлагается полностью до ВаО. Уравнение температурной зависимости давления пара над твердым и жидким Ва(ОН)2 имеют вид соответственно:
lgP (Па) = 14,892 – 184964/09,155 Т,
lgP (Па) = 9,847 – 118767/19,155 Т.
Система Ва–С. Установлено одно соединение ВаС2 (14,88% С). Ниже приведены температурные зависимости изменения энергии Гиббса реакций образования карбида ВаС2 (в Дж/моль):
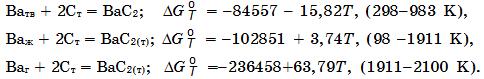
ВаС2 как и карбиды других металлов ІІ группы имеют ионный тип химической связи. Карбид ВаС2 кристаллизуется в гранецентрированной тетрагональной решетке типа СаС2, плавится свыше 2000°С разложением, имеет плотность 3,895 г/см3. Энтальпия образования ВаС2 ∆Н ообр = –75,42 кДж/моль, стандартная энтропия S![]() = 87,78 Дж/(моль×K). Температурная зависимость теплоемкости ВаС2 описывается уравнением (кал/(моль×K):
= 87,78 Дж/(моль×K). Температурная зависимость теплоемкости ВаС2 описывается уравнением (кал/(моль×K):
СP = 17,6 + 0,9Т – 2,31Т-2, (298 – 1500 K).
Система Ba–Si(рис. 18.1). Известны силициды бария BaSi (83,07% Ва, 16,93% Si) и BaSi2 (71,03% Ва, 28,97% Si). Соединение BaSi2 плавится конгруэнтно при 1180°С, а BaSi инконгруэнтно при 840°С (по перитектической реакции). В системе Ва-Si имеются две эвтектики с температурами эвтектического превращения 630°С и 1020°С. Растворимость кремния в твердом барии очень малая; при эвтектической температуре 630°С она не превышает 0,14% (ат.). Стандартное изменение энергии Гиббса образования силицида BaSi ∆G![]() = –75,9 кДж/моль. Парциальная молярная энтальпия растворения бария в жидком кремнии D`Н = -237 кДж/моль, а максимальная молярная энтальпия образования расплавов системы BaSi DН = -52,5 кДж/моль при 40% Ва.
= –75,9 кДж/моль. Парциальная молярная энтальпия растворения бария в жидком кремнии D`Н = -237 кДж/моль, а максимальная молярная энтальпия образования расплавов системы BaSi DН = -52,5 кДж/моль при 40% Ва.
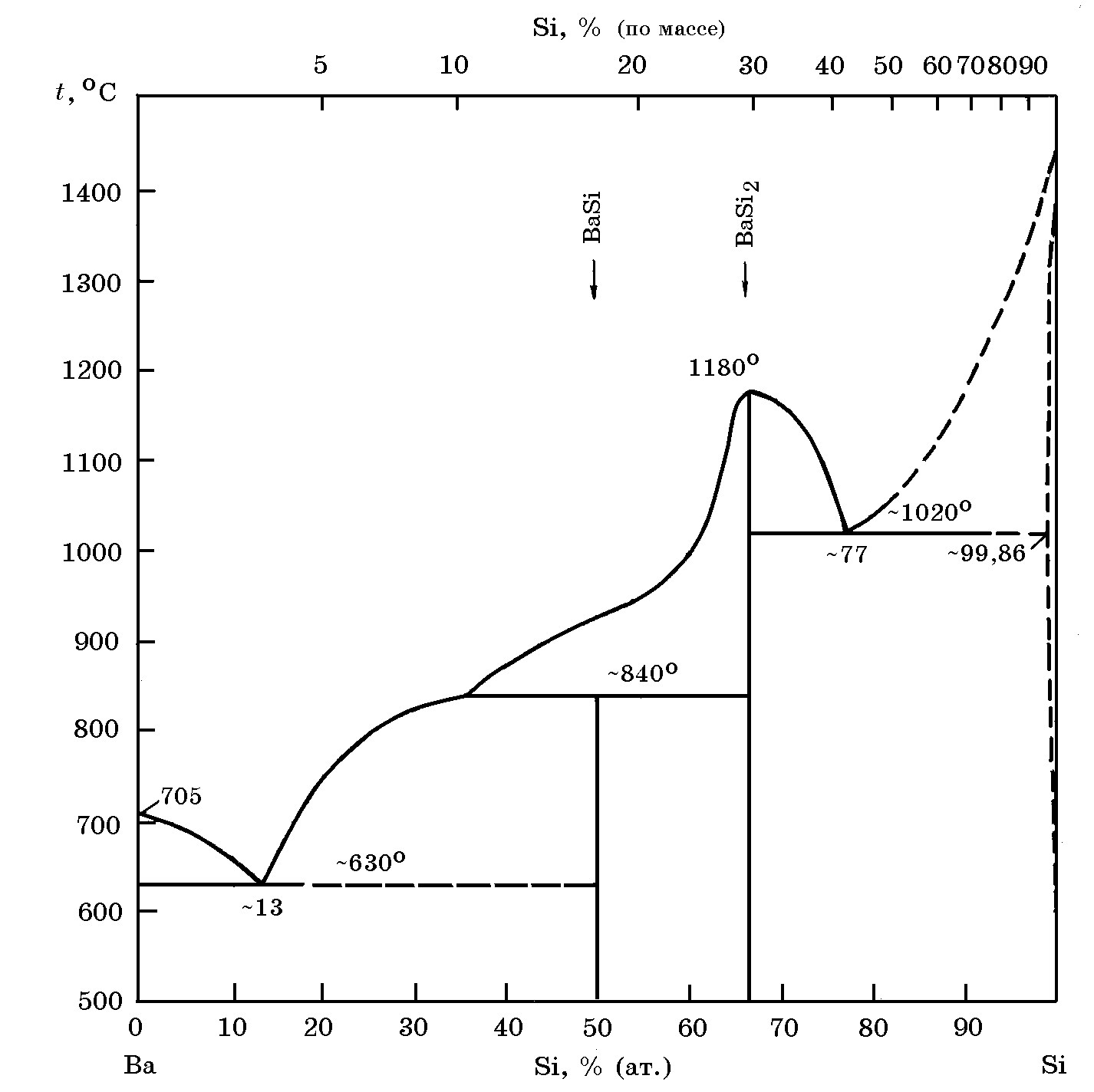
Рис. 18.1. Диаграмма равновесного состояния системы Ba–Si
Система Ва–S(рис. 18.2). Барий с серой образует несколько сульфидов, из которых хорошо изучено соединение ВаS (81,07% Ва, 18,93% Si), плавящееся при 2200°С (положение ВаS на диаграмме не приведено). Сплавлением исходных бария и серы получены соединения Ва2S (10,45% S), ВаS2 (31,83% S), ВаS3 (41,19% S). Температуры превращений этих сульфидов приведены на рис. 18.2. Сульфид ВаS кристаллизуется в кубическую решетку типа NaCl (а = 0,6381 нм), плотность 4,252 г/см3. Теплота образования ВаS ∆Н![]() = –453,08 кДж/моль, стандартная энтропия S
= –453,08 кДж/моль, стандартная энтропия S![]() = 78,16 Дж/(моль×K), теплоемкость С oP = 48,98 Дж/(моль×K). При хранении на воздухе ВаS поглощает СО2, образуя ВаСО3 и Н2S. При прокаливании на воздухе BaS окисляется до ВаSО4.
= 78,16 Дж/(моль×K), теплоемкость С oP = 48,98 Дж/(моль×K). При хранении на воздухе ВаS поглощает СО2, образуя ВаСО3 и Н2S. При прокаливании на воздухе BaS окисляется до ВаSО4.
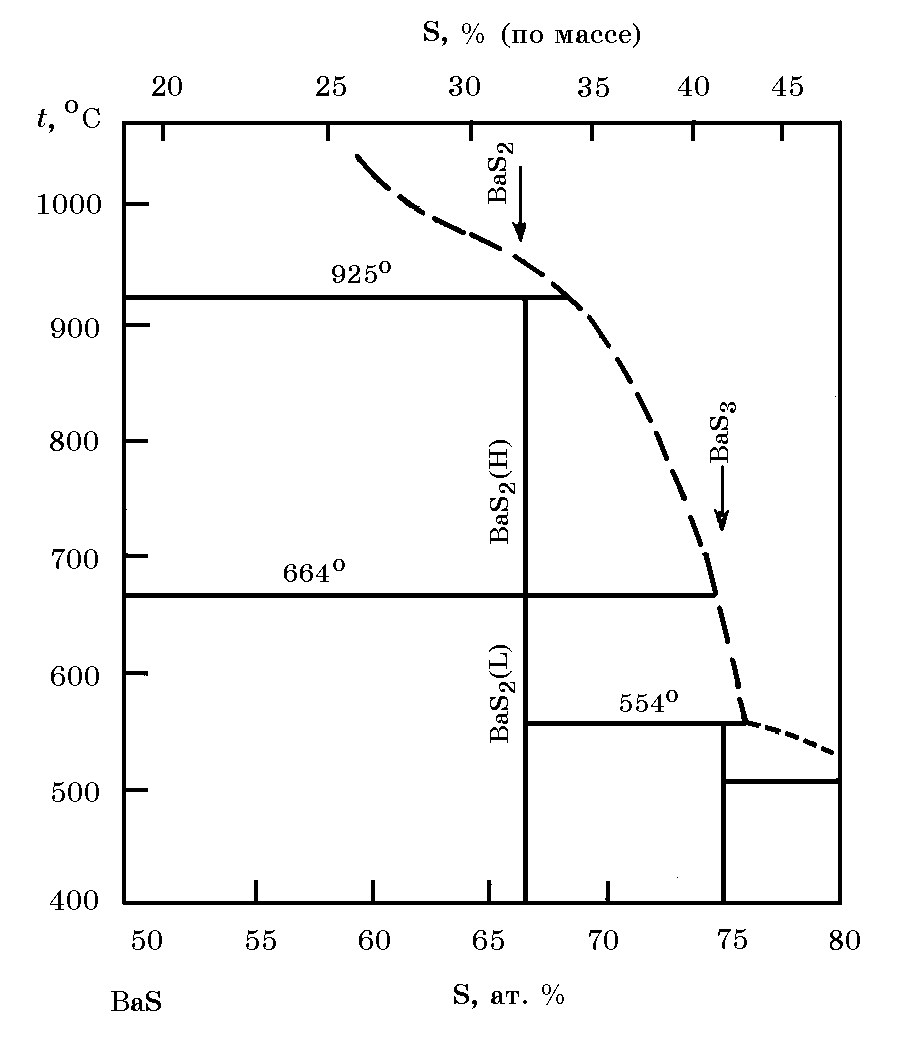
Рис. 18.2. Диаграмма равновесного состояния Ва–S
Зависимости изменения энергии Гиббса реакций образования BaS из элементов от температуры описываются следующими уравнениями:
Важ + 1/2S2г = ВаSтв; ∆G![]() =–486242 + 98,18T (977–1911 K),
=–486242 + 98,18T (977–1911 K),
Ваг + 1/2S2г = ВаSтв; ∆G![]() =–683101+177,08Т (1911–2473 K).
=–683101+177,08Т (1911–2473 K).
Высокая термодинамическая прочность сульфида бария позволяет использовать барий в качестве десульфуратора чугуна и стали.
Сульфат бария. В природе барий представлен рудным минералом баритом BaSO4, который используется для выплавки барийсодержащих ферросплавов. Сульфат бария характеризуется следующими термодинамическими свойствами ∆G ообр = –1348,0 кДж/моль; ∆Н![]() = –1459,0 кДж/моль, S
= –1459,0 кДж/моль, S![]() = 132,1 Дж/(моль×К); СP = 102,1 Дж/(моль∙K).
= 132,1 Дж/(моль×К); СP = 102,1 Дж/(моль∙K).
При нагревании BaSO4 диссоциирует по реакции
BaSO4 = ВаО + SO2 + 1/2O2,
∆G![]() = 603702 – 315,5Т Дж/моль.
= 603702 – 315,5Т Дж/моль.
Константа термической диссоциации BaSO4 при 1873 K равна 8,41×10–2, что подтверждает большую термодинамическую устойчивость сульфата.
Система Ва–Р. При анализе возможности образования соединений в системе Ва-Р следует учитывать термодинамические свойства фосфора – элемента V группы Периодической системы элементов Д.И. Менделеева. Фосфор существует в нескольких аллотропных модификациях. Белый (желтый) фосфор кристаллизуется в кубической сингонии. Температура плавления фосфора 44,14°С, температура возгонки 287°С. Стандартные значения S![]() = 41,1 Дж/(моль×K), С oP = 23,8 Дж/(моль×K). При горении образует оксид Р4О10. Фосфор получают восстановлением фосфорита коксом в присутствии SiO2 при 1300-1500°С по реакции:
= 41,1 Дж/(моль×K), С oP = 23,8 Дж/(моль×K). При горении образует оксид Р4О10. Фосфор получают восстановлением фосфорита коксом в присутствии SiO2 при 1300-1500°С по реакции:
2Са3(РО4)2 + 10С + n∙SiO2 → P4 + 10CO + 6CaO∙nSiO2.
Образующиеся пары фосфора конденсируется на охлаждаемой поверхности в виде белого (желтого) фосфора и собираются под слоем нагретой до 60°С воды. Фосфор очень ядовит, смертельная доза для человека 0,05–0,15 г; ПДК в воздухе 0,03 мг/м3.
В системе Ва–Р известны соединения ВаР2, ВаР3. Наиболее изучен фосфид Ва2Р2 (86,91% Ва и 13,09% Р). Стандартная теплота образования Ва3Р2 ∆Н ообр = –493,2 кДж/моль.
Система Ва–Al(рис. 18.3). Образуется одно соединение ВаAl4, плавящееся конгруэнтно при 1097°С. По обе стороны этого алюминида бария существуют эвтектики: при 1,0% (ат.) Ва и 651°С и при 70% (ат.) и Ва 528°С.
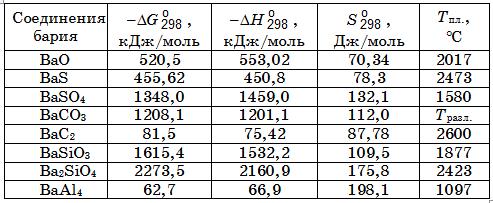
Термодинамические константы важных для электрометаллургии барийсодержащих ферросплавов сведены в табл. 18.1.
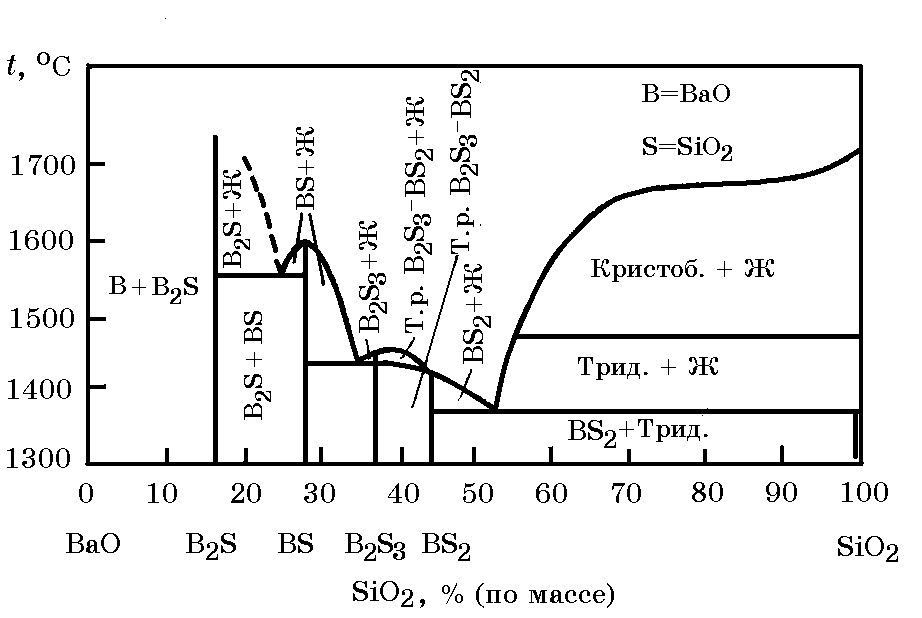
Рис. 18.3. Диаграмма равновесного состояния системы Bа–Al
Таблица 18.1. Термодинамические константы некоторых соединений бария
Система ВаО–SiO2(рис. 18.4). В системе образуется ряд соединений (силикатов бария), термодинамические свойства которых приведены ниже:


Рис. 18.4. Диаграмма равновесного состояния системы ВаО–SiO2
Дисиликат бария 2BaO×SiO2 имеет две модификации, температура превращения α-2BaO×SiO2 → β-2BaO×SiO2 равна 1350°С; дисиликат β-2BaO×SiO2 плавится при 1760°С. Изменение энергии Гиббса реакции образования дисиликата
2ВаО + SiO2 = 2BaO×SiO2,
в зависимости от температуры имеет вид (в Дж/моль):
∆G![]() = –274202 + 39,86Т.
= –274202 + 39,86Т.
Плотность дисиликата равна 3,73 г/см3. Данные о термодинамических свойствах соединений в системе 2BaO×SiO2 имеют большое значение при анализе процесса получения ферросиликобария.
Система ВаО–Al2O3(рис. 18.5). Известны алюминаты бария, составы и температуры плавления которых приведены ниже:
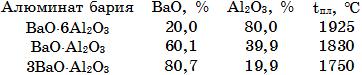
Технология выплавки ферросиликобария. Ферросплавы с барием можно получать, применяя в качестве восстановителей углерод, кремний и алюминий.Наиболее экономичным является углеродотермический способ выплавки барийсодержащего ферросплава – ферросиликобария, с использованием баритового концентрата (65,7% ВаО и 34,3% SO3), кварцита и кокса. Совместное восстановление Ва и Si из этой шихты в общем виде может быть представлено реакцией:
ВаSO4 + SiO2 + 4C → BaSi + 4CO + SO2.
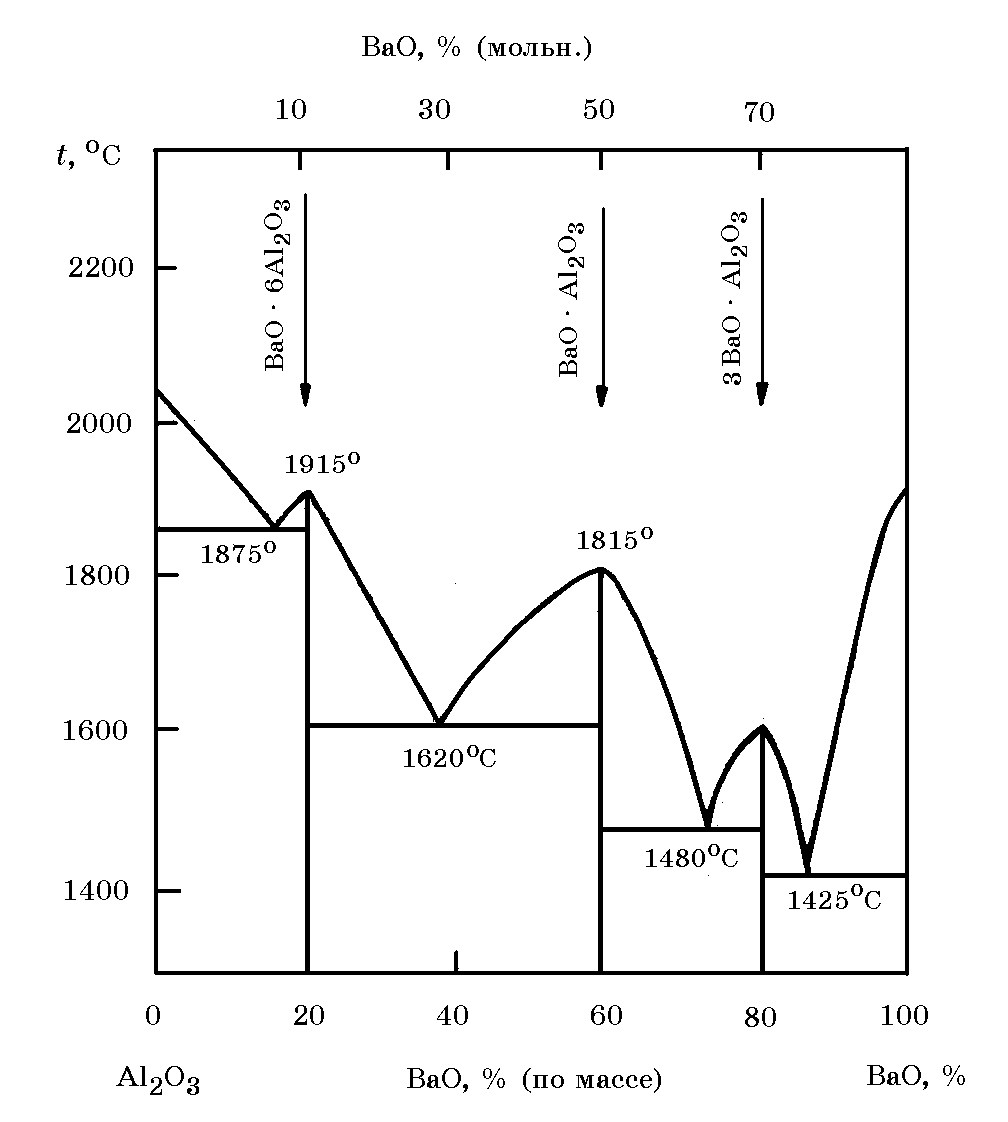
Рис. 18.5. Диаграмма равновесного состояния системы ВаО–Al2O3
Плавку ведут в дуговой электропечи непрерывным процессом. Ферросиликобарий, полученный углеродотермическим процессом, имеет следующий химический состав (% по массе):
![]()
При этом печной шлак содержит 19–26% Ваобщ, 25–37% SiO2, 3–7% C, 3–5% S.
Силикотермический процесс основан на реализации реакции восстановления бария из ВаО кремнием ферросилиция (ФС75)
2ВаО + 3/2[Si]ФС75 = BaSi + 1/2(2BaO×SiO2).
Этим способом получают ферросиликобарий с содержанием бария до 25% или комплексный сплав с содержанием Ва и Са. Плавку ведут в дуговой электропечи периодическим процессом. Шихту составляют из расчета получения состава одной колоши: 100–120 кг ВаО, 190 кг ФС75; 200 кг извести, 50 кг плавикового шпата. Полученный комплексный ферросплав имеет химсостав, %: 5 Ва; 15 Са; 27 Fe; 1,5 Al, ост. Si.
Технология выплавки алюминобария. Сплавы системы Al–Ba характеризуются высокой раскислительной способностью, поскольку каждый компонент в отдельности имеет высокое сродство к кислороду, растворенному в металлических расплавах. Эти лигатуры могут применяться и как модификаторы структуры конструкционных сталей и различных сплавов на железной основе.
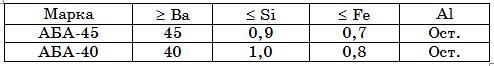
Основой технологического процесса выплавки алюминобариевых лигатур является реакция восстановления оксидов бария алюминием. Шихту составляют так, чтобы в сплаве получалось ≥ 40 и 45% Ва при регламентированном содержании Si и Fe (табл. 18.2).
Таблица 18.2. Химический состав, %, Al–Ba лигатуры
Расчетный состав колоши: на 100 кг пероксида бария требуется 55,8 кг алюминиевой крупки и 11,0 кг флюоритового концентрата.
Шихтовые материалы. Пероксид бария с содержанием ВаО2 ≥ 93% и алюминиевая крупка фракционного состава: 0–0,1 мм ≤ 20%, 0,1–1,0 мм ≥ 70% и 1,0–3,0 мм ≤ 15% и плавиковый шпат с содержанием СаF2 ≥ 95%.
Технология плавки лигатуры. Алюминобариевую лигатуру получают внепечным алюминотермическим методом в чугунной изложнице диаметром 1 м и высотой 0,6 м с надставкой – обечайкой из листового железа 5–10 мм. Дозировка шихты ведется из расчета 200–250 кг пероксида бария. Сдозированная шихта смешивается в смесителе барабанного типа из коррозионностойкой стали емкостью 0,5м3 (12 об./мин). Плавку проводят с верхним запалом. Из-за малой плотности лигатуры блок получаемого сплава находится над шлаком. Блок-лигатура охлаждается, а затем подвергается дроблению и упаковке.
Пероксид бария относится к группе токсических веществ с сильными окислительными свойствами. Шихта может воспламеняться вне плавильной камеры. В воздухе рабочей зоны плавильного участка предельно допустимая концентрация ВаО2 установлена ≤ 0,05 мг/м3.