18.2. Электрометаллургия ферросиликостронция |
Содержание > ГЛАВА 18. Электрометаллургия ферросплавов со щелочноземельными и редкоземельными металлами > 18.2. Электрометаллургия ферросиликостронция
Физико-химические свойства стронция и его соединений. Стронций* – химический элемент ІІ группы Периодической системы элементов Д.И.Менделеева, атомный номер 38, атомная масса 87,62, конфигурация внешней электронной оболочки атома 5s2, относится к группе щелочно-земельных металлов. Природный стронций состоит из четырех стабильных изотопов:8838Sr (82,56%), 8638Sr(9,86%), 8738Sr(7,02%) и 8438Sr(0,56%). Степень окисления стронция 2, очень редко 1. Металл существует в трех аллотропных модификациях, превращение которых проходит при следующих температурах:
![]()
Энтальпия плавления стронция ∆Нпл= 8,2 кДж/моль, энтальпия испарения ∆Нисп = 133,8 кДж/моль, энтропия ∆S![]() = 55,70 Дж/(моль×K).
= 55,70 Дж/(моль×K).
Система Sr–O. В системе Sr–O образуется оксид SrO, представляющий собой бесцветные кристаллы плотностью 4,7 г/см3. Температура плавления SrO 2660°С, ∆Н ообр = –590,5 кДж/моль, энтропия S![]() = 55,44 Дж/(моль×K). При прокаливании SrO в среде О2 при высоком давлении образуется переоксид SrO2. При взаимодействии SrO с Н2О образуется гидрооксид Sr(OН)2 – бесцветные гигроскопичные кристаллы, температура плавления 535°С, плотность 3,632 г/см3, ∆С oP = 92,06 Дж/(моль×K); ∆Н ообр = –965
= 55,44 Дж/(моль×K). При прокаливании SrO в среде О2 при высоком давлении образуется переоксид SrO2. При взаимодействии SrO с Н2О образуется гидрооксид Sr(OН)2 – бесцветные гигроскопичные кристаллы, температура плавления 535°С, плотность 3,632 г/см3, ∆С oP = 92,06 Дж/(моль×K); ∆Н ообр = –965
кДж/моль, S![]() = 94 Дж/(моль×K).
= 94 Дж/(моль×K).
Зависимости изменения энергии Гиббса реакций образования оксида SrO при взаимодействии стронция различного агрегатного состояния с молекулярным кислородом от температуры имеют вид (в Дж/моль):
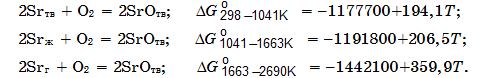
Температурная зависимость давления пара над SrO в предположении, что диссоциация SrO не имеет места, описывается уравнением
lgPобщ(атм) = 1,44 + 1,908lgT – 25950/Т (700–1600 K).
Система SrO–СО2. Карбонат стронция SrСО3 – бесцветные кристаллы, существуют в нескольких полиморфных модификациях:
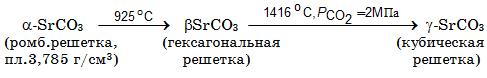
Температура плавления SrСО3 1494°С, ∆Нообр = –1227,0 кДж/моль, энтропия S![]() = 97,2 Дж/(моль×K). При нагревании SrСО3 диссоциирует по реакции
= 97,2 Дж/(моль×K). При нагревании SrСО3 диссоциирует по реакции
SrСО3 ↔ SrО + СО2.
Уравнения температурной зависимости давления термической диссоциации SrСО3 имеют вид
![]()
Система Sr–C. В системе Sr–C образуется термодинамически прочный карбид SrC2 (∆Н![]() = –81,43 кДж/моль, S
= –81,43 кДж/моль, S![]() = 75,5 Дж/(моль×K). Изменение энергии Гиббса реакций образования карбида с участием стронция в различном агрегатном состоянии в зависимости от температуры описывается уравнениями (в Дж/моль):
= 75,5 Дж/(моль×K). Изменение энергии Гиббса реакций образования карбида с участием стронция в различном агрегатном состоянии в зависимости от температуры описывается уравнениями (в Дж/моль):

Давление паров стронция над карбидом SrC2 в зависимости от температуры представлено уравнением
![]()
Система Sr–Si (рис. 18.6). В системе Sr–Si образуются силициды SrSi (75,77% Sr, 24,23% Si) и SrSi2 (61,01% Sr, 38,99% Si). Силициды SrSi и SrSi2 плавятся конгруэнтно при 1140 и 1150°С соответственно. В системе имеются три эвтектики с температурами ~ 700, 1044 и 1000°С. Сообщается также о существовании соединения Sr2Si.
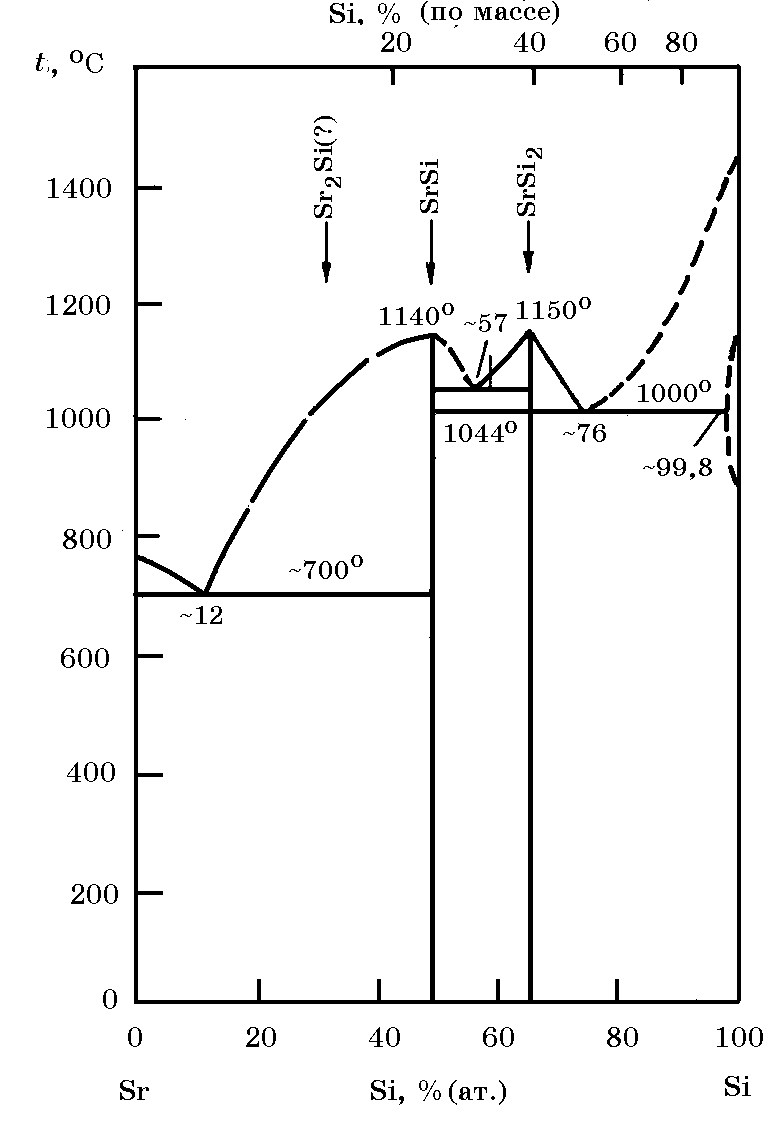
Рис. 18.6. Диаграмма равновесного состояния системы Sr–Si
Система SrO–SiO2 (рис. 18.7). В системе существуют кристаллические фазы (силикаты) 2SrO×SiO2, SrO×SiO2. Температура плавления 2SrO×SiO2 точно не установлена, но она выше 1700°С. Соединение SrO×SiO2 плавится конгруэнтно при 1580°С. Наиболее низкая эвтектическая температура 1358°С. Силикаты стронция характеризуются сравнительно высокой термодинамической прочностью, что подтверждается приведенным ниже изменением энергии Гиббса реакций их образования из компонентов, Дж/моль:
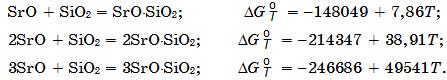
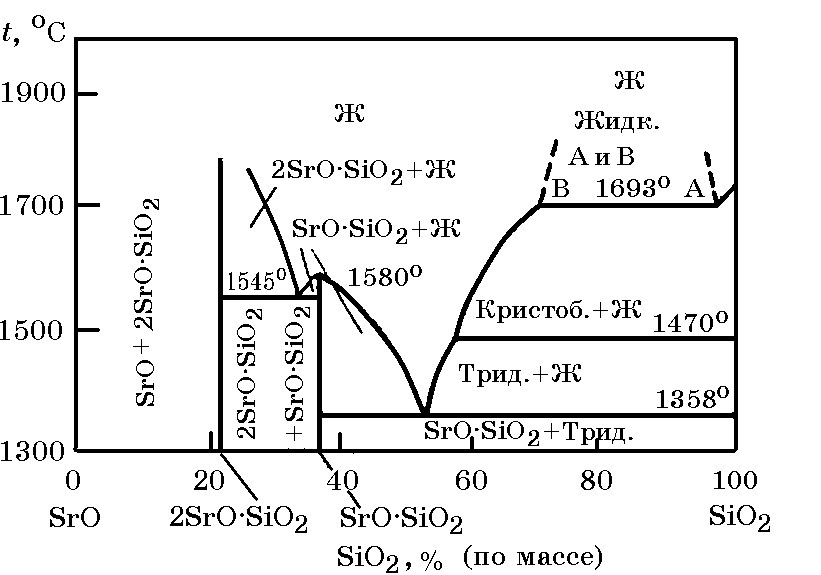
Рис. 18.7. Диаграмма равновесного состояния системы SrO–SiO2
Система SrO–Al2O3 (рис. 18.8). В этой системе установлено существование соединений 4SrO×Al2O3, 3SrO×Al2O3 (tпл = 1660°С), SrO×Al2O3 (tпл = 1790°С), SrO×2Al2O3 (tпл = 1820°С) и SrO×6Al2O3 (tпл = 1900°С). Соединение 4SrO×Al2O3 имеет две модификации: высокотемпературную (α-4SrO×Al2O3), устойчивую в области 1320–1690°С, и низкотемпературную (β-4SrO×Al2O3), устойчивую в области 1125–1320°С. Наиболее низкая эвтектическая температура 1505°С.
Сводные термодинамические свойства ряда соединений стронция обобщены в табл. 18.3
Таблица 18.3. Физико-химические свойства некоторых соединений стронция
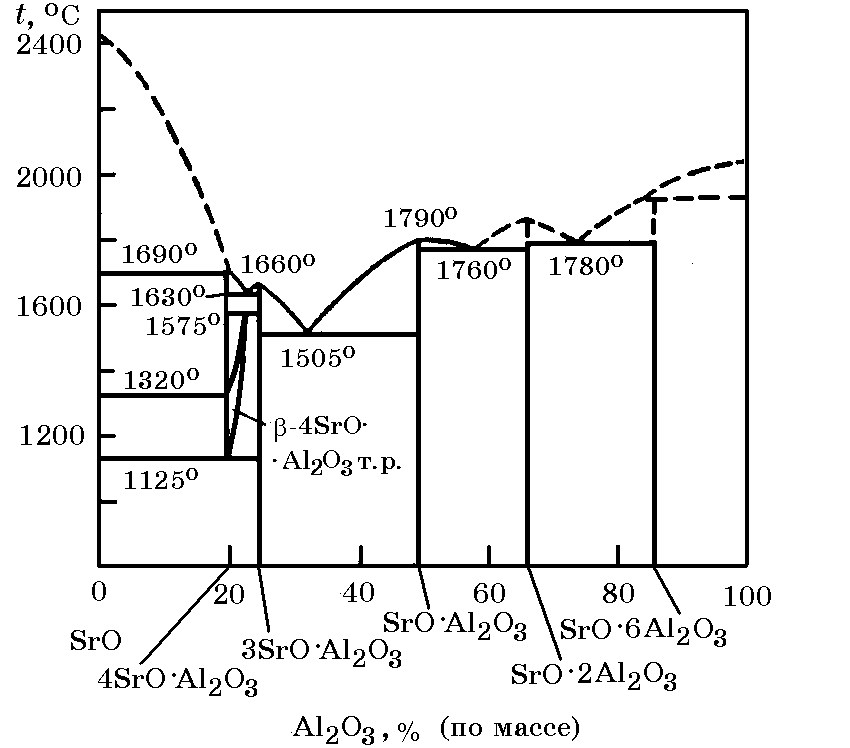
Рис. 18.8. Диаграмма равновесного состояния системы SrO–Al2O3
Минералы и руды стронция. Содержание стронция в земной коре 3,4×10-2% (по массе), в свободном виде не встречается. Стронций образует около 40 минералов, из которых промышленные значения имеют целестин SrSO4 и стронцианит SrCO3. Стронций присутствует в качестве изоморфной примеси в различных магниевых, кальциевых (Sr, Ca)2 B14O23×8H2O и бариевых минералах, а также содержится в природных минерализованных видах (около 24% общих запасов стронция).
Часть стронция в океане концентрируется в железомар-
ганцевых конкрециях. На основании обобщения многочисленных данных исследований химического состава океанических железомарганцевых отложений выявлена положительная корреляция стронция и других элементов (Ni, Cu, Co, Vo, W, Ba) к марганцевым фазам конкреций, а Ti, V, Cr, Al, Pb, Y и Si – к железосодержащим фазам.
Технология выплавки ферросиликостронция. Стронций присутствует в природных минеральных образованиях в основном в виде целестина SrSO4. Целестиновый концентрат содержит около 86% SrSO4. При высокотемпературном взаимодействии сульфата SrSO4 c углеродом образуются сульфид SrS и СО (в Дж/моль):
SrSO4 + 4С = SrS + 4СО; ∆G![]() = 517371 – 700,95Т.
= 517371 – 700,95Т.
В присутствии SiO2 восстановление стронция до силицида протекает по реакции (в Дж/моль):
SrSO4 + 4С + SiO2 = SrSi + SO2 + 4СО;
∆G![]() = 993109 – 820,19Т.
= 993109 – 820,19Т.
Наряду с силицидной фазой при недостатке углерода в системе протекают реакции с образованием силикатов стронция (в Дж/моль):
SrSO4 + 1/2SiO2 + С = 1/2(2SrО∙SiO2) + СО + SO2;
∆G![]() = 127458 – 197,57Т.
= 127458 – 197,57Т.
Ферросиликоцирконий получали в дуговой электропечи мощностью 160 кВ∙А при напряжении 30 В и токе 1500 А. Шихта состояла из целестинового концентрата, кварцита, коксика и железной стружки. Полученный ферросиликостронций содержал 8-10% Sr, 48–59% Si, остальное – железо. Кратность шлака равнялась 1,5. В опытных кампаниях по выплавке ферросиликостронция в крупнолабораторной печи удельный расход электроэнергии был высоким, а полезное использование стронция низким. Совершенствование технологии выплавки ферросиликостронция приведет к снижению расхода электроэнергии.
Для получения комплексного сплава стронция с барием, а также прямого легирования стали и сплавов Sr и Ва, рационально использовать концентраты, содержащие карбонаты SrCO3 и ВаСО3. Концентрат марки БСК-2 крупно-
стью до 10 мм имеет следующий химический состав, %:
![]()