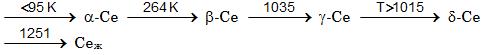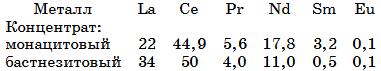18.4. Электрометаллургия ферросплавов с редкоземельными металлами |
Содержание > ГЛАВА 18. Электрометаллургия ферросплавов со щелочноземельными и редкоземельными металлами > 18.4. Электрометаллургия ферросплавов с редкоземельными металлами
Физико-химические свойства РЗМ и их соединений. В соответствии с классификацией к РЗМ относятся лантан (z = 58¸71), лантаноиды (элементы от лантана до лютеция, z = 71), а также скандий (z = 21) и иттрий (z = 39). Из 17
элементов семейства РЗМ, относящихся к группе редкоземельных металлов, в черной металлургии используются, в основном, три: иттрий, лантан и церий (z = 58), хотя в ферросплавах этого вида могут присутствовать в различных количествах и другие РЗМ.
Иттрий химический элемент ІІІ группы Периодической системы Д.И.Менделеева, атомный номер 39, атомная масса 88,90. Природный иттрий состоит из одного стабильного изотопа 8939Y. Конфигурация внешних электронных оболочек 4d15s2, степень окисления +3.
Иттрий аллотропный металл, до 1482°С устойчива модификация α-Y с гексагональной решеткой (а = 3647 нм), плотностью 4,45 г/см3. Выше 1482°С устойчива модификация β-Y с кубической решеткой (а = 0,408 нм) типа α-Fe. Температура плавления иттрия 1528°С, температура кипения около 3320°С; ∆Нопл = 11,32 кДж/моль; S = 44,43 Дж/(моль×K). Давление пара при 1450°С равно 6,15×10-2 Па.
= 44,43 Дж/(моль×K). Давление пара при 1450°С равно 6,15×10-2 Па.
Сесквиоксид иттрия Y2O3(рис. 18.12) плавится при 2430°С, кипит при 4300°С. Существует в двух модификациях. До 2277°С сохраняется кубическая кристаллическая решетка, а при 2277°С и выше – гексагональная решетка. Теплота образования Y2O3 ∆Н = –1905 кДж/моль, стандартная энтропия S
= –1905 кДж/моль, стандартная энтропия S = 99,16 Дж/(моль×K).
= 99,16 Дж/(моль×K).
Лантан химический элемент ІІІ группы, атомный номер 57, атомная масса 138,90, относится к редкоземельным металлам. Природный лантан состоит из двух стабильных изотопов 13957La (99,911%) и радиоактивного 13857La (0,089%) с периодом полураспада Т1/2 =2×1011 лет. Конфигурация электронной оболочки 5d16s2, степень окисления +3. До температуры 277°С устойчива гексагональная модификация α-La (а = 0,3772 нм, с = 1,2144 нм). В интервале 277–861°С устойчива кубическая решетка (а = 0,5296 нм) плотностью 6,19 г/см3. В пределах 861–920°С – существует γ-модификация лантана с кубической решеткой типа α-Fe (а = 0,426 нм), плотностью 5,97 г/см3. Температура плавления лантана 920°С, кипения 3454°С. Стандартная энтропия S = 56,7 Дж/(моль×K).
= 56,7 Дж/(моль×K).
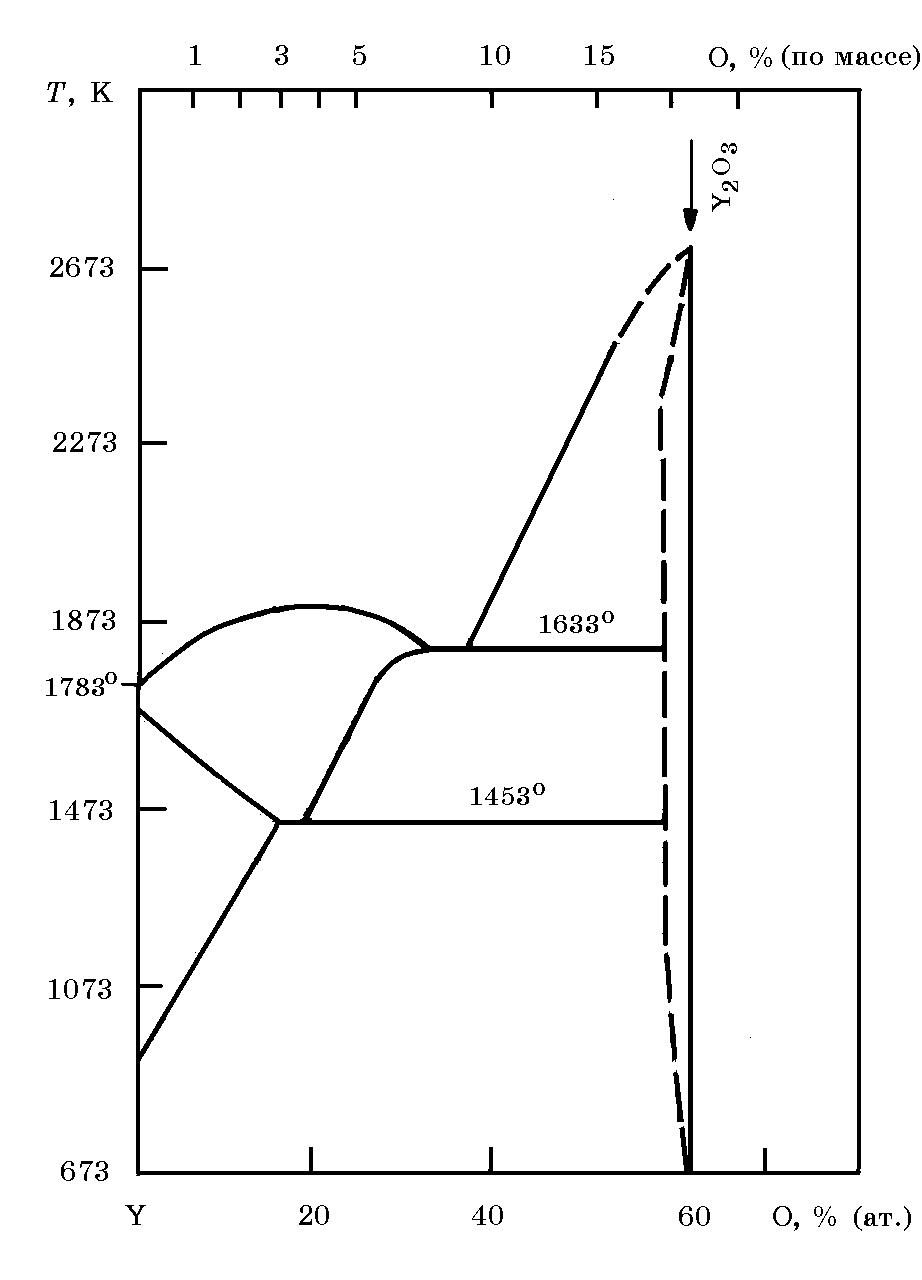
Рис. 18.12. Диаграмма равновесного состояния системы Y–O
Сесквиоксид La2O3 плавится при 2313°С, теплота образования ∆Н = –1794,2 кДж/моль, стандартная энтропия S
= –1794,2 кДж/моль, стандартная энтропия S = 127,3 Дж/(моль×K). Образование La2O3 из элементов по реакции
= 127,3 Дж/(моль×K). Образование La2O3 из элементов по реакции
2La + 3/2O2 = La2O3
сопровождается изменением энергии Гиббса (в Дж/моль):
∆G = –1869290 + 38,45ТlgT – 405,04T (298–1000 K).
= –1869290 + 38,45ТlgT – 405,04T (298–1000 K).
Церий* химический элемент ІІІ группы Периодической системы элементов, атомный номер 58, атомная масса
140,12. В природном церии четыре стабильных нуклида 13658Се (0,19%), 13858Се (0,25%), 14058Се (88,48%) и 14258Се (11,08%).
Конфигурация внешних электронных оболочек атома церия 4f26s2, степень окисления +3, реже +4. Известно 4 кристаллические модификации церия
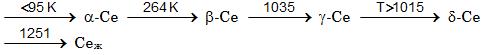
Температура плавления церия 798°С, теплота плавления ∆Н опл = 5,23 кДж/моль, стандартная энтропия S = 71,5 Дж/(моль×K).
= 71,5 Дж/(моль×K).
Диоксид церия СеО2 (рис. 18.13) плавится при 2400°С. Стандартные значения энергии Гиббса образования СеО2 ∆G ообр = –1024,5 кДж/моль, S = 62,30 Дж/(моль×K). Cесквиоксид Се2О3 ∆Н ообр = –1090 кДж/моль не устойчив, в присутствии О2 быстро окисляется с выделением большого количества тепла.
= 62,30 Дж/(моль×K). Cесквиоксид Се2О3 ∆Н ообр = –1090 кДж/моль не устойчив, в присутствии О2 быстро окисляется с выделением большого количества тепла.
Системы РЗМ–Fe. Система Y–Fe (рис. 18.14). Иттрий с железом образует четыре химических соединения: YFe9 (tпл = 1400°С), YFe4 (tпл = 1300°С), YFe3 (tпл = 1400°С), эти интерметаллиды плавятся конгруэнтно; соединение YFe2 плавится инконгруэнтно при 1125°С. В сплаве богатым иттрием образуется эвтектика при 65,3% (ат.) Y и 900°С. В жидком состоянии иттрий и железо образуют непрерывные растворы. Первая парциальная теплота растворенных иттрия в железе составляет ∆Hy = –26,7 кДж/моль, железа в иттрии ∆Hy = –22,9 кДж/моль. Максимальное значение интегральной теплоты раствора ∆НY = –8,44 кДж/моль при 47% (ат.) иттрия.
Система La–Fe. Лантан с железом не образует химических соединений. В жидком состоянии имеют неограниченную растворимость. Граничная растворимость лантана в
твердом железе не превышает 0,1% (ат.).
При содержании 91,5% (ат.) La образуется эвтектика (tэвт. = 785°С).
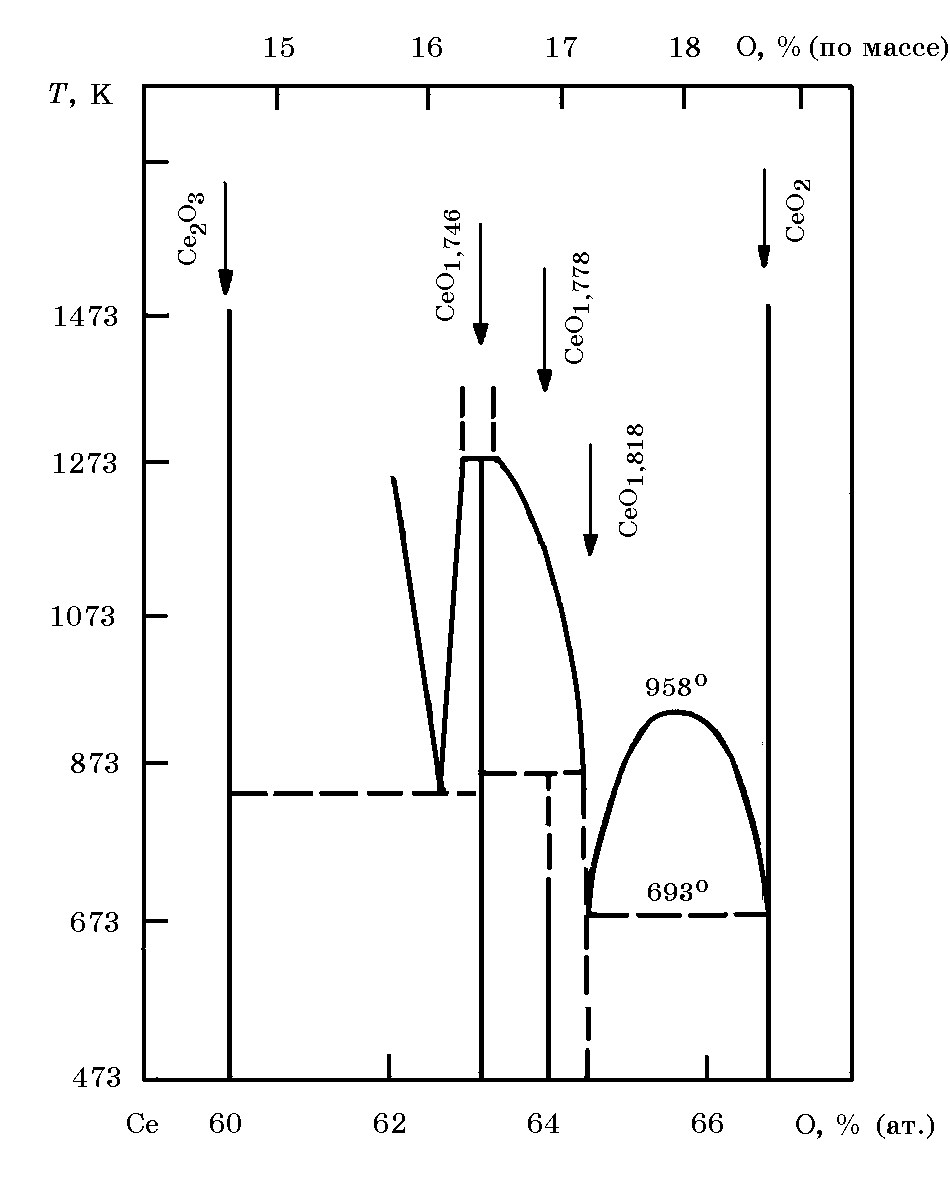
Рис. 18.13. Диаграмма равновесного состояния системы Се–О
Система Се–Fe(рис. 18.15). Установлено два химических соединения СеFe2 и СеFe5, плавящихся инконгруэнтно при 925 и 1060°С соответственно. Существует одна эвтектика с координатами 14% (ат.) Се и температурой 592°С.
Системы РЗМ–С. Система Y–C (рис. 18.16). Установлено существование карбидов YC, Y2C3 YC2. Карбид Y2C3 образуется по перитектоидной реакции: твердый раствор на основе YC + YC2 → Y2C3 при температуре 1500°С. Эвтектическая жидкость, содержащая ~ 15% (ат.) С, распадается на твердый раствор на основе иттрия с ≤ 2% (ат.) С и промежуточную фазу – твердый раствор на основе карбида YC, который существует при ~ 40% (ат.) С и имеет небольшую область гомогенности. Карбид YC2 образуется конгруэнтно при 2300°С. Стандартная теплота образования карбида YC2 ∆Нообр = 112 кДж/моль.
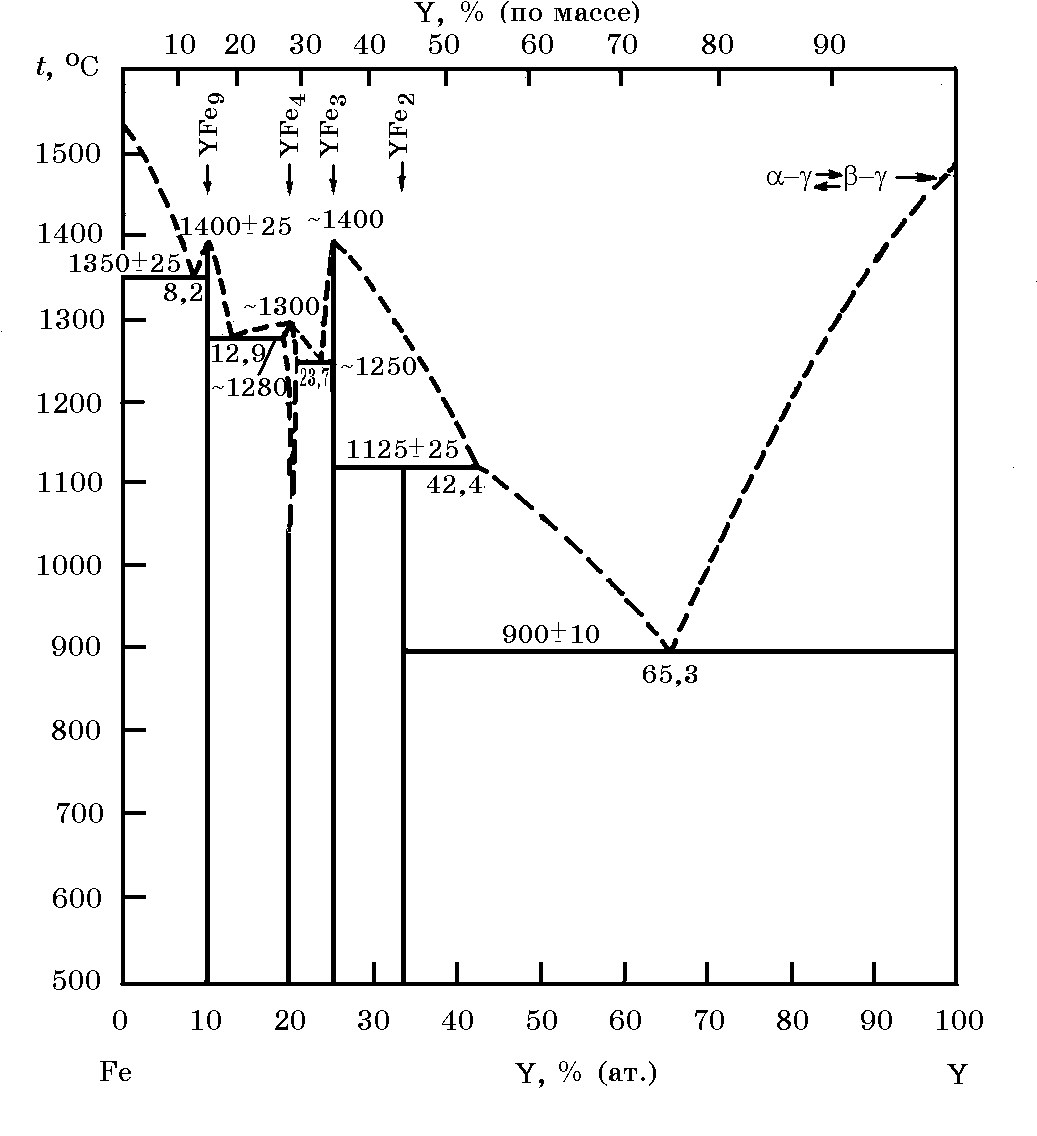
Рис. 18.14. Диаграмма равновесного состояния системы Y–Fe
Система La–C (рис. 18.17). На диаграмме приведены два карбида La2C3 и LaC2. Отмечается, что карбид LaC не существует. Карбид LaC2 имеет тетрагональную кристаллическую решетку, плотность 5,35 г/см3, плавится при 2360°С. Теплота образования LaC2 равна ∆Нообр = –91,23 кДж/моль.
Система Се–С. Установлено, что в системе существуют карбиды Се2С2 и СеС2; наличие карбида СеС не подтверждено. Период кубической решетки Се2С3 равен а = 0,844 нм. Карбид СеС2 имеет тетрагональную решетку, плотность 5,6 г/см3, температуру плавления 2290°С. Теплота образования СеС2 ∆Нообр = –62,85 кДж/моль. Карбид Се2С3 образуется по перитектической реакции при температуре выше 1700°С.
По данным О. Кубашевского и К. Олкока стандартная теплота образования ∆Нообр карбидов Се2С3 и СеС2 соответственно равна 176,39 и 97,39 кДж/моль, а стандартная энтропия этих карбидов S равна 173,5 и 89,87 Дж/(моль×K).
равна 173,5 и 89,87 Дж/(моль×K).
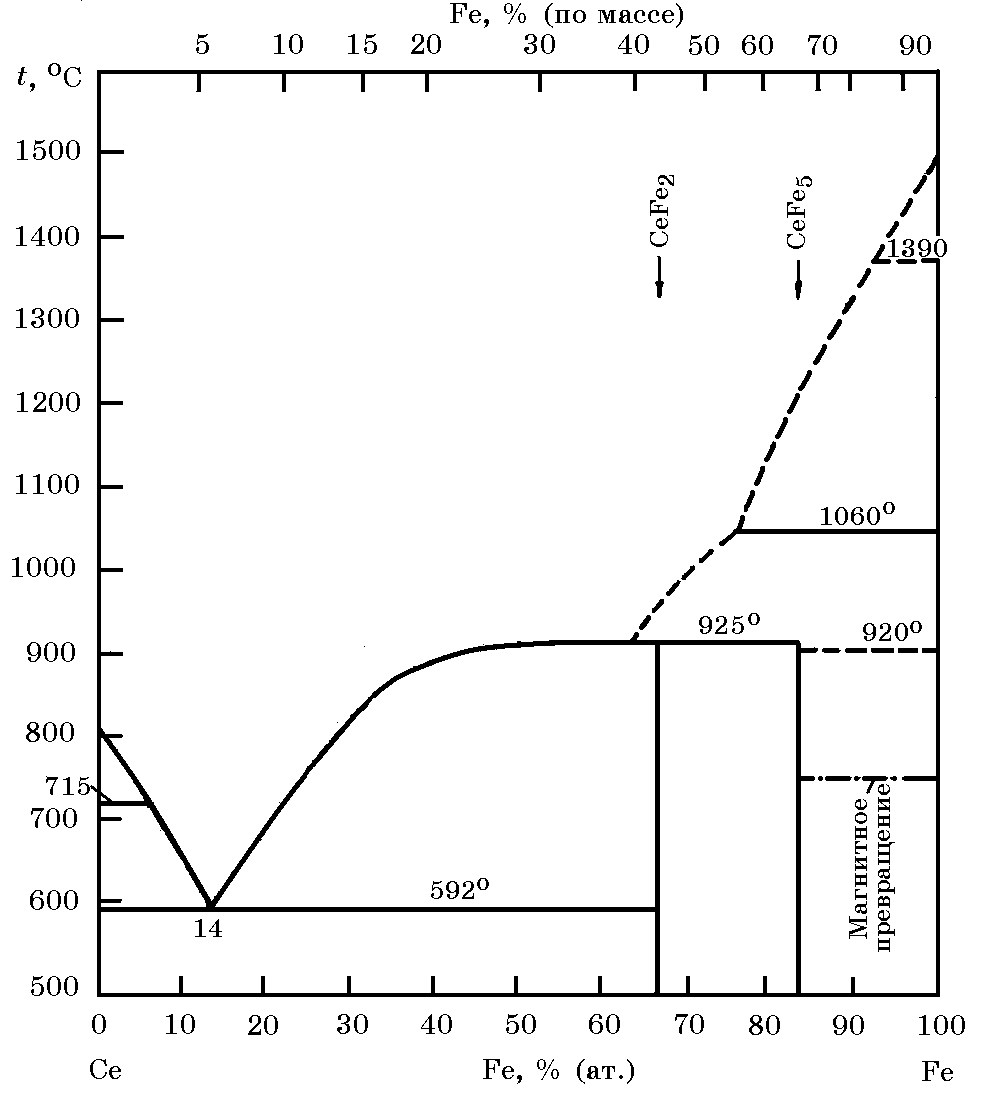
Рис. 18.15. Диаграмма равновесного состояния системы Ce–Fe
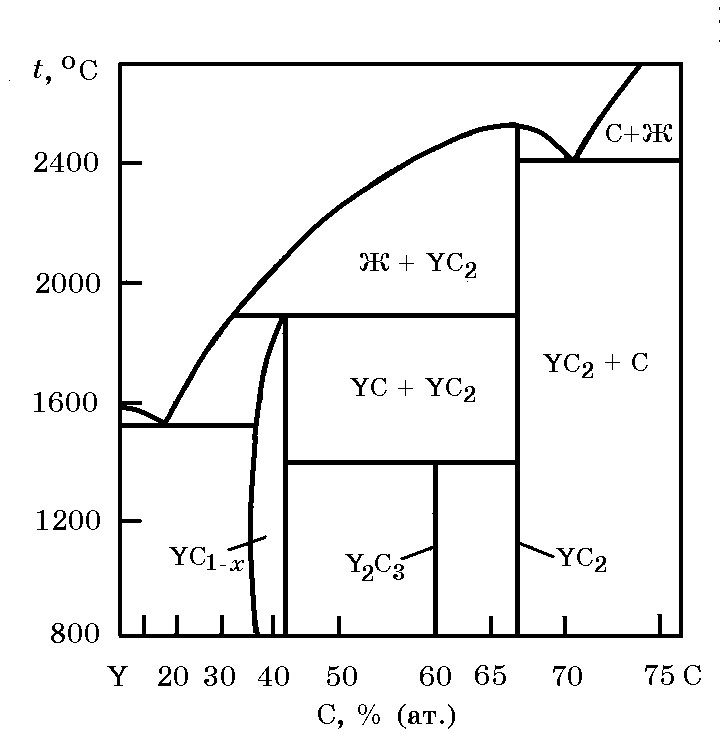
Рис. 18.16. Диаграмма равновесного состояния системы Y–C
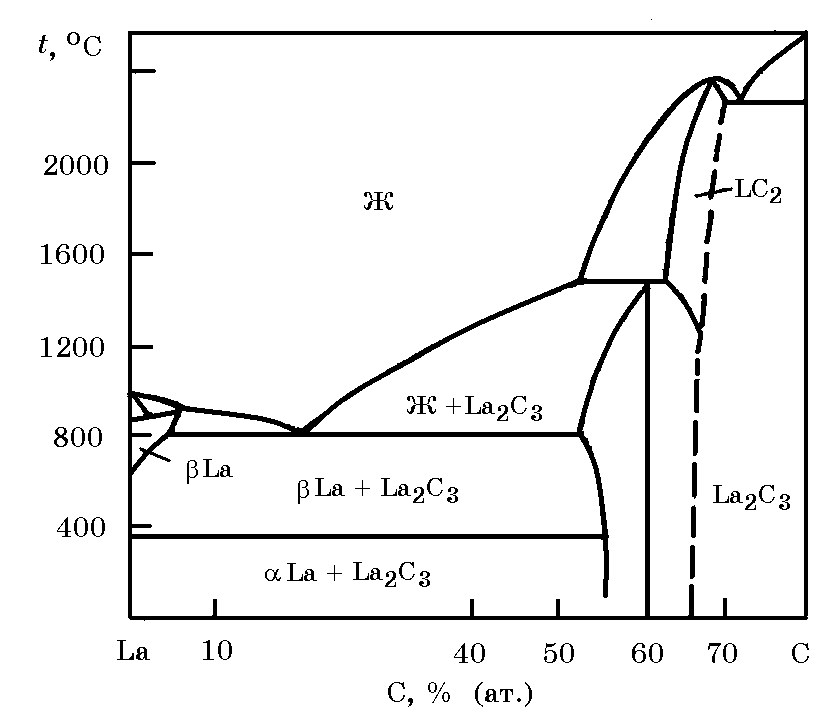
Рис.18.17. Диаграмма равновесного состояния системы La–C
Система Y–Si (рис. 18.18). Существуют четыре соединения (силицида иттрия) Y5Si3 (tпл. = 1850°С); Y5Si4 (tпл. = 1840°С); YS и Y3Si5 (температура инконгруэнтного плавления 1635°С). В системе Y–Si имеется три эвтектики: две относительно низкотемпературные 1260 и 1215°С и одна высокотемпературная 1710°С, образующаяся в частной системе Y5Si3–Y5Si4. Растворимость иттрия в твердом кремнии ничтожно мала. Важнейшие свойства соединения YSi: сингония ромбическая, температура плавления 1835°С, плотность 4,33 г/см3, теплота образования ∆Н ообр = –134,8 кДж/моль.
Система La–Si. Известны соединения LaSi, La3Si2 и LaSi2. Температура плавления LaSi2 принята равной 1520°С. Этот силицид кристаллизуется в тетрагональной сингонии, имеет плотность 5,05 г/см3, теплота образования ∆Н ообр = –185,9 кДж/моль.
Система Се–Si. Известные соединения (силициды) CeSi, Ce5Si3 и CeSi2 кристаллизуется в тетрагональной сингонии, имеет плотность 5,31 г/см3, теплоту образования ∆Н ообр = –2093,3 кДж/моль.
Минералы, руды и концентраты РЗМ. РЗМ сравнительно широко распространены в природе. Если содержание алюминия в земной коре принять за 100 единиц, то количество РЗМ составит 0,18, что намного больше меди и кобальта (0,12), урана (0,10), вольфрама (0,060), молибдена (0,001). В природе РЗМ встречаются в виде оксидов, фосфатов, карбонатов, фторкарбонатов и других соединений. Основными минералами, содержащими РЗМ, являются: бастнезит (Се, La) [FCO3] плотностью r = 4,2 – 5,2 г/см3; монацит (Се, La, Nd, Th)[PO4] включает примеси ThO2 (до 10%), UO2 (6,6%), ZrO2 и др. Монацит чаще всего встречается в пегматитовых породах и используется как сырье для получения церия и тория. Лопарит – минерал группы фторкарбонатов РЗМ с формулой Са(Се, La)2[CO3]F2 содержит 30,5% Се2О3; 10,44% СаО и 24,58% СО2. Минералы пирохлоровой группы имеют общую формулу (Са, Na, U, Ce, Y)2-m × (Nb, Ta, Ti)2O6(OF)1-m × H2O и делятся на минералы, богатые РЗМ, танталом, ураном, титаном и другими элементами.
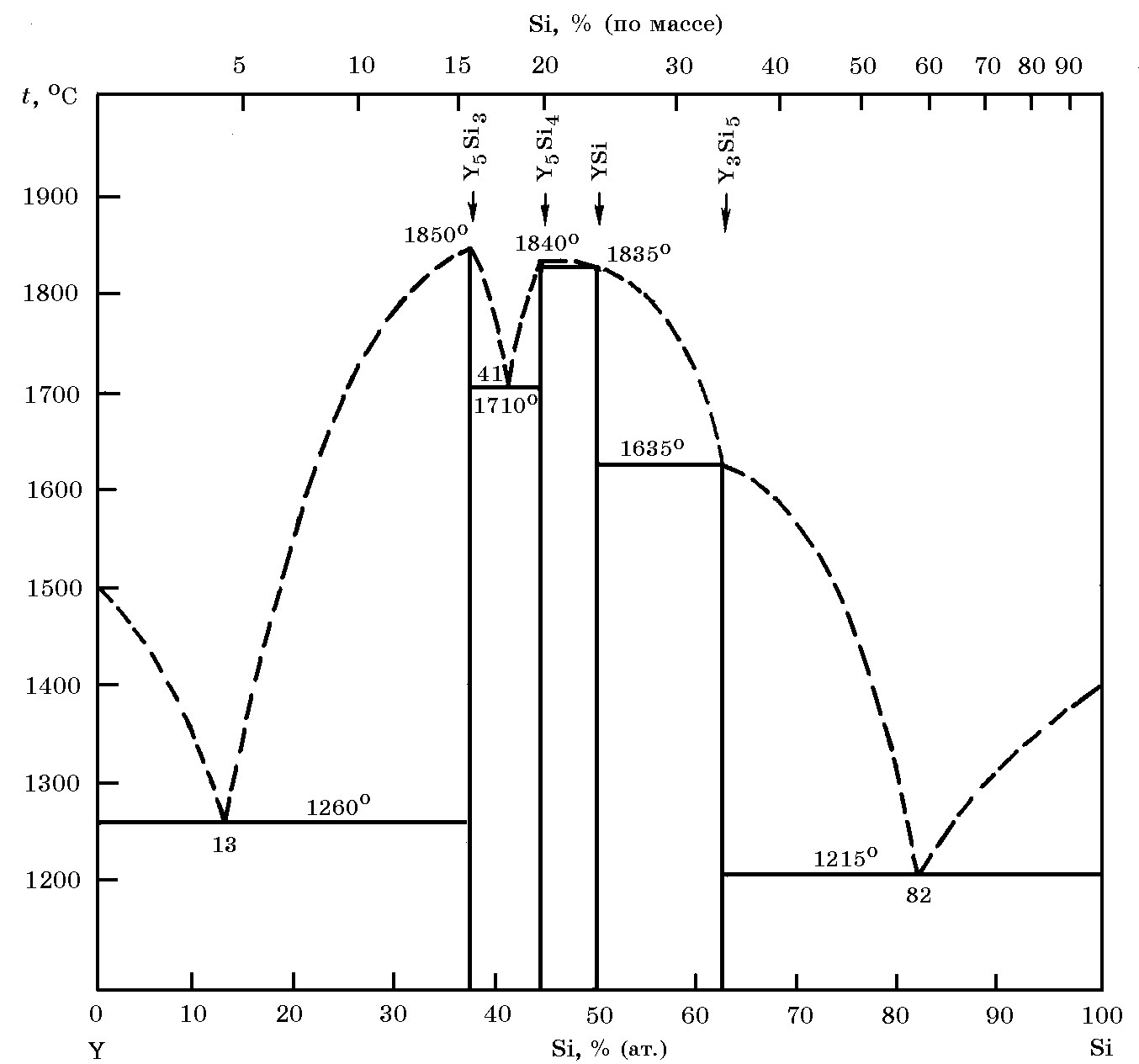
Рис. 18.18. Диаграмма равновесного состояния системы Si–Y
Основными промышленными источниками РЗМ являются бастнезит, монацит и ксенотим*. Первый из них образует собственные месторождения, два других – второстепенные: ильменит – рутил-цирконовые, оловянные и другие россыпи. Около 16% иттрия поступает из отходов уранового сырья.
Руды, содержащие минералы РЗМ, обычно подвергают гравитационному обогащению для выделения тяжелых минералов – монацита, ксенотима и др. Монацит* из смеси с другими минералами выделяют сочетанием гравитационного, электромагнитного и электростатического методов. Химические методы переработки концентратов включают выщелачивание, отделение радиоактивных примесей, выделение химических концентратов, разделение самих РЗМ и получение металлов. Бастнезитовые* концентраты выщелачивают соляной кислотой, из нерастворенного осадка выделяют цериевый концентрат. Лопаритовые*, бастнезитовые* концентраты перерабатывают также хлорированием.
Используемые в настоящее время монацитовый и бастнезитовый концентраты содержат 60 и 70% оксидов РЗМ соответственно. Массовая доля каждого элемента РЗМ в этих концентратах характеризуется приведенными ниже данными, %:
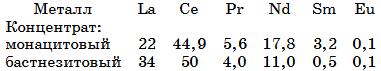
Технология получения ферросплавов с РЗМ. Углеродотермический способ. Сплавы РЗМ с кремнием выплавляют в рудовосстановительных печах непрерывным методом (табл. 18.5). Шихта содержит концентрат РЗМ, кварцит, углеродистый восстановитель и стальную стружку. Особое значение имеет точное дозирование углерода для восстановления оксидов РЗМ и кремния, так как при отклонении количества углерода и шихте наблюдается образование карбидной настыли на подине печи (SiC, РЗМС, РЗМС2, оксиды РЗМ и SiO2) и не достигается достаточно хорошее извлечение РЗМ. Получение РЗМ происходит по реакции:
РЗМ2О3 + SiO2 + 5C → РЗМSi + 5CO.
Реакция получает значительное развитие при Т > 2000 K. Восстановление РЗМ термодинамически облегчается вследствие уменьшения активности их при растворении в кремнии и железе. В ферросплаве с 30–40% РЗМ элементы РЗМ находятся в составе силицидов. Восстановительные процессы сопровождаются образованием оксикарбидов и карбидов.
Таблица 18.5. Химический состав, %, ферросплавов с РЗМ на ферросилициевой основе
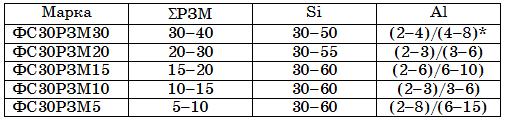
* Алюминотермическая технология
Увеличение содержания РЗМ в сплаве приводит к уменьшению извлечения металлов вследствие образования газообразных оксидов (РЗМО) и повышения количества шлака. Плотность шлака с увеличением содержания кремния в сплаве приближается к плотности металлического расплава. Целесообразно выплавлять сплавы не выше 35–45% РЗМ, что приводит к более полному использованию РЗМ при выплавке стали и чугуна.
Алюминотермический способ. Значительное количество лигатур, содержащих РЗМ, производят алюминотермическим методом теоретические основы и технологические параметры которого разработаны Н.П.Лякишевым и др. Для реакции восстановления РЗМ алюминием
РЗМ2О3 + 2Al = 2РЗМ + Al2O3
величина изменения энергии Гиббса (∆G ) положительная. Поэтому для достижения достаточной степени извлечения РЗМ в металл должно быть повышенное количество алюминия в шихте и, следовательно, в сплавах, а процесс необходимо вести с подводом большого количества тепла. В шихту вводят алюминий > 100% от теоретически необходимого (получая лигатуру, содержащую 3–7% Al) и значительное количество кремния, что создает дополнительные благоприятные условия для уменьшения активности РЗМ при их растворении в кремнии.
) положительная. Поэтому для достижения достаточной степени извлечения РЗМ в металл должно быть повышенное количество алюминия в шихте и, следовательно, в сплавах, а процесс необходимо вести с подводом большого количества тепла. В шихту вводят алюминий > 100% от теоретически необходимого (получая лигатуру, содержащую 3–7% Al) и значительное количество кремния, что создает дополнительные благоприятные условия для уменьшения активности РЗМ при их растворении в кремнии.
Лигатуру выплавляют в дуговой печи с футеровкой подины и стен углеродистой массой. Мощность трансформатора печи сталеплавильного типа ДСН-3 составляет 1,8 МВ×А. Шихта включает концентрат РЗМ иттриевой или цериевой подгруппы, концентрат оксида лантана, содержащий 40-47% СеО2, 41-48% (La2O3 + Nd2O3 + Pr2O3). Восстановителем служит порошок первичного или вторичного алюминия (в зависимости от химического состава получаемой лигатуры). В шихту вводят ферросилиций ФС75, низкофосфористый железный концентрат (> 63% Fe), а в качестве флюсов используют свежеобожженную известь и плавиковый шпат. На 100 кг концентрата расходуется 32–41 кг алюминиевого порошка, 110–125 кг ферросилиция, 30–37 кг извести, 0–5 кг железного концентрата и плавикового шпата.
Шихту заваливают после набора электрической нагрузки. Шихту делят на две части: в первую входит 55–75% концентрата, 60–65% извести, 60% ферросилиция, 42% алюминиевого порошка. Вначале проплавляют первую часть шихты с постепенной и равномерной ее загрузкой, и после выдержки расплава под током в течение 5–7 мин вводят остальной ферросилиций, алюминиевый порошок, известь и оксиды РЗМ. По окончании проплавления второй части шихты и выдержки расплава под током шлак и металл выпускают в футерованный тигель, установленный на поддоне в плавильной камере. Затем охлаждают тигель и выкатывают из камеры, разделывают летку и выпускают металл в чугунную изложницу.
Плотность металла, содержащего 11–40% РЗМ, 33–52% Si, 7–9% Al, 5–6,3% Ca, 0,01–0,03% C, 12–20% Fe, колеблется в пределах 3,3–3,9 г/см3, а плотность шлака составляет 3,0–3,6 г/см3, что может вызывать потери РЗМ со шлаком. При введении в шлак плавикового шпата и хлорида натрия уменьшается плотность шлака, что способствует улучшению отделения металла от шлака.
Расход материалов на 1 т лигатур с РЗМ следующий, кг: концентрата оксидов РЗМ 565/520; алюминиевого порошка 210/203; извести 225/225; ферросилиция ФС75 695/630; руды железной 35/33; при расходе электроэнергии 2149/2184 кВт×ч (числитель – для лигатуры иттриевой подгруппы, знаменатель – для лигатуры цериевой подгруппы.
По технологии выплавки лигатур с РЗМ, разработанной ЦНИИЧМ и КЗФ, восстановление оксидов редкоземельных элементов на первой стадии плавки проводят силикотермическим процессом, а на второй – алюминотермическим. Проведенные исследования показали высокую степень извлечения редкоземельных элементов в металл (92–97%) и получение известково-глиноземистого шлака с низким содержанием оксидов РЗМ (1,6–4,8%). Освоение разработанной технологии выплавки лигатур с РЗМ на Ключевском заводе ферросплавов позволило повысить извлечение РЗМ в металл до 92–95% и снизить себестоимость 1 т лигатуры (30% РЗМ). Полученные в процессе производства известково-глиноземистые шлаки с содержанием 50–60% Al2O3, 35–40% СаО и до 5% оксидов РЗМ эффективно применяются при внепечной обработке.
Электролитический способ. РЗМ в чистом виде и как мишметалл > 98% РЗМ, в том числе > 45% Ce и 25% La, получают электролизом безводных хлоридов РЗМ в присутствии хлоридов щелочных металлов при 800–900°С в стальных аппаратах, стенки которых служат катодом, а графитовые стержни – анодом. Индивидуальные РЗМ получают металлотермическим восстановлением их фторидов. В качестве восстановителей используют Са, реже Mg, а также Na. Получаемые индивидуальные РЗМ рафинируют переплавкой в вакууме.
Получение РЗМ электролизом требует большого удельного расхода электроэнергии (~ 15–16 кВт×ч/т).
Раскислительная способность РЗМ*. Ферросплавы с РЗМ используются при производстве стали для раскисления, модифицирования структуры и неметаллических включений, поскольку содержащиеся в оксидных фазах MnO, SiO2 и Al2O3 могут восстанавливаться РЗМ, вводимыми в жидкую сталь.