∆G
19.2. Термокинетические закономерности диссоциации известняков |
Содержание > ГЛАВА 19.Физикохимия и технология получения извести > 19.2. Термокинетические закономерности диссоциации известняков
Известняк представляет собой нерудный природный материал, состоящий в основном из минерала кальцита СаСО3 (56% СаО, 44% СО2) и примесных оксидов (MgO, SiO2, Fe2O3).
При нагревании кальцита до температуры 900–1100°С он термически диссоциирует по реакции
СаСО3тв → СаОтв + СО2(газ).
Температурная зависимость изменения стандартной энергии Гиббса реакции термической диссоциации СаСО3 описывается уравнением
СаСО3тв = СаОтв + СО2газ,
∆G![]() = -168245 + 143,79Т, Дж/моль.
= -168245 + 143,79Т, Дж/моль.
Условие ∆G![]() = 0 при РCO2 = 100 кПа выполняется при 1170 K (897°С). Зависимость логарифма упругости диссоциации СаСО3 от температуры имеет вид:
= 0 при РCO2 = 100 кПа выполняется при 1170 K (897°С). Зависимость логарифма упругости диссоциации СаСО3 от температуры имеет вид:
![]()
Важнейшей особенностью кристаллохимических превращений при термической диссоциации кальцита является участие в этом процессе кристаллических фаз СаСО3, СаО с поверхностью раздела, которую определяют как реакционную поверхность. Реакция диссоциации кальцита локализуется на межфазной поверхности СаСО3–СаО. По мере нагревания и изотермической выдержки реакционная граница перемещается вглубь куска известняка, а кристаллическая решетка СаСО3 трансформируется в кристаллическую решетку СаО.
Кинетические кривые диссоциации известняка приведены на рис. 19.1 в координатах «степень превращения (w) – время» и «скорость превращения (v) – время». Зависимость w(t) обычно получают экспериментально, обжигая образцы известняка при заданной температуре и различной продолжительности обжига. Кривые w(t) рассчитывают по данным экспериментов или дифференцированием функции w(t).
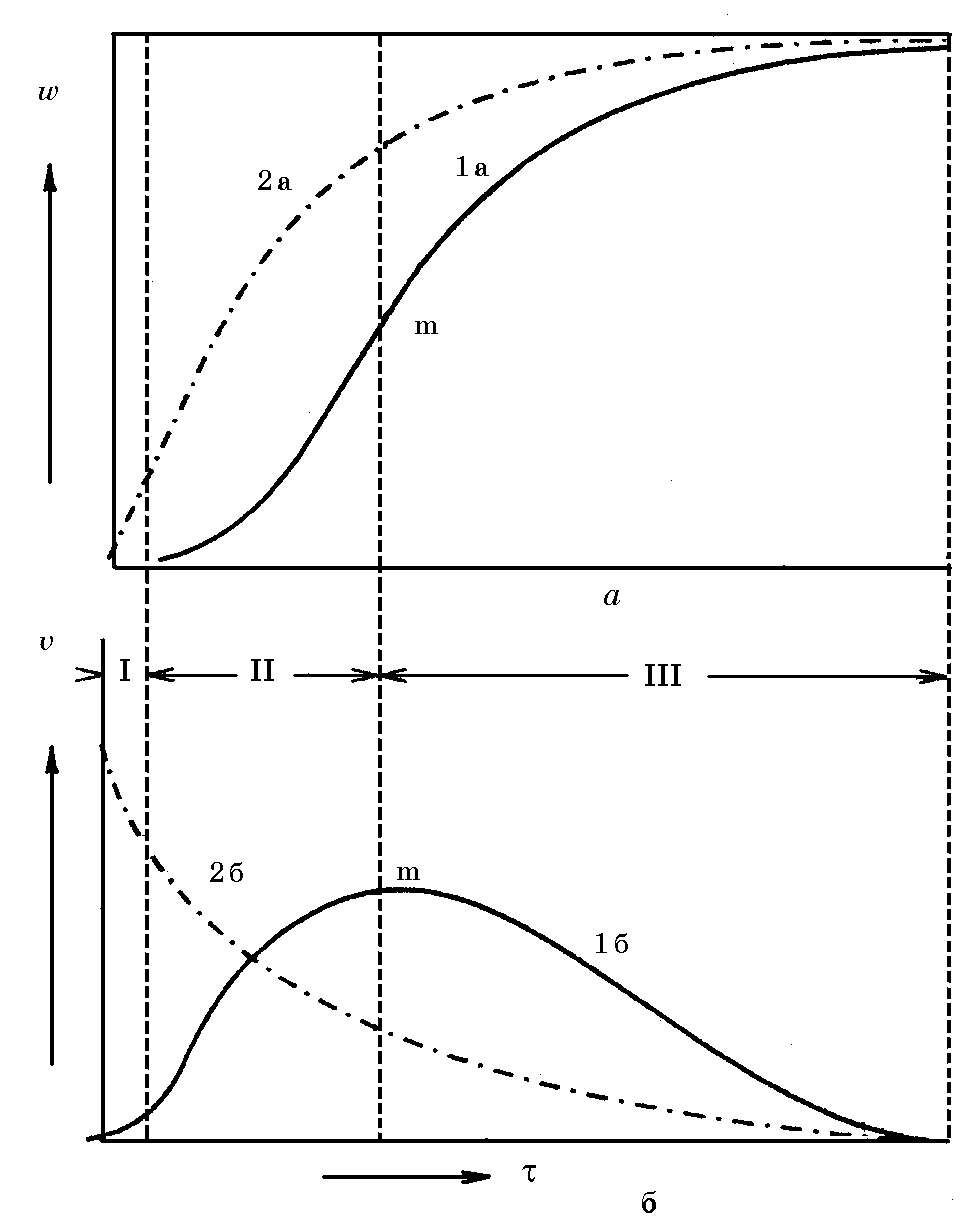
Рис. 19.1. Кинетика топохимических реакций: а – изменение степени превращения во времени; б – изменение скорости превращения
во времени
Кривые w(t) и v(t) по С.Т. Ростовцеву относятся к наиболее общему случаю диссоциации известняка, когда в топохимической реакции проявляются все три периода: І – индукционный; ІІ – автоматический и ІІІ – пери-
од усредненного фронта*. Началом кристаллохимического акта диссоциации СаСО3 является распад карбонат–иона CO2-3 → O2- + [CO2]. Кривые 1а и 1б относятся к случаю наличия автокаталитического периода, а кривые 2а и 2б, когда продолжительность этого периода исчезающе мала.
На следующем этапе диссоциации молекула СО2 переходит в адсорбированное состояние [CO2] → (CO2)ад, а завершающим элементным актом химической части процесса является десорбция с отводом СО2 в газовую фазу.
В ходе кристаллохимического превращения в решетке карбоната кальция накапливаются катионы Са2+ с последующим преобразованием раствора СаО в СаСО3. Растворимость СаО в СаСО3 невелика, и поэтому уже на ранних стадиях процесса достигается насыщение, а затем и пересыщение решетки карбоната кальция оксидом СаО и наступает перестройка кристаллической решетки в СаО. При этом объем кристаллической фазы СаО в 2,2–2,4 раза меньше объема фазы СаСО3. По С.Т.Ростовцеву переход одной кристаллической фазы СаСО3 в другую СаО складывается из двух процессов: первоначально формируются зародыши новой фазы, а затем идет их рост. В отличие от роста зародышей, рост кристаллов сопровождается значительными перемещениями частиц. По мере их роста диффузионные перемещения усиливаются.
Размерами кристаллитов (зерен) получаемой извести определяется ее химическая активность при растворении в шлаковых расплавах. С ростом температуры обжига известняка, увеличиваются размеры кристаллов извести, и снижается ее химическая активность. Известно, что в тех случаях, когда требуется получить известь достаточно устойчивую к влаге, обжиг ведут при высоких температурах, а еще более устойчивую - путем переплава извести в дуговых электропечах с получением электроплавленной извести с крупными кристаллами.
В составе известняков в меньшем или большем количестве содержится карбонат магния MgCO3 ∆Н![]() = –111062 Дж /моль, S
= –111062 Дж /моль, S![]() = 65,79 Дж/(моль×K), который при нагревании термически диссоциирует по реакции с образованием MgO ∆Н
= 65,79 Дж/(моль×K), который при нагревании термически диссоциирует по реакции с образованием MgO ∆Н![]() = 600,6 кДж/моль, S
= 600,6 кДж/моль, S![]() = 26,91 Дж/(моль×K) и СО2
= 26,91 Дж/(моль×K) и СО2
MgCO3 = MgO + CO2,
∆G![]() = 117458 – 169,77Т, Дж/моль.
= 117458 – 169,77Т, Дж/моль.
Температурная зависимость упругости диссоциации MgCO3 имеет вид
![]()
Температура начала термической диссоциации, т.е. для условий ∆G![]() = 0 и РCO2 = 100 кПа равна 698 K (425°С). Однако эта температура не соответствует экспериментальным данным, согласно которым зависимость упругости диссоциации MgCO3 описывается уравнением
= 0 и РCO2 = 100 кПа равна 698 K (425°С). Однако эта температура не соответствует экспериментальным данным, согласно которым зависимость упругости диссоциации MgCO3 описывается уравнением
![]()
а температура, при которой lgРCO2 = 1 атм равна 923 К (650°С).
Сложный карбонат Са и Mg эквимолярного состава рассматривают как изоморфную смесь СаСО3×MgCO3, или как двойную соль [Ca, Mg (CO3)2]. Термическая диссоциация «доломита» протекает в две стадии:
СаСО3×MgCO3 → СаСО3+MgO+СО2,
на второй стадии происходит диссоциация СаСО3.